Name: Hopemaster, 2020-11
Batterien sind galvanische Zellen, meist mit unterschiedlichen Halbzellen. Baut man hingegen galvanisches Element, welches aus zwei identischen Halbzellen besteht, fließt nur dann ein (schwacher Strom), wenn die Lösungen eine unterschiedliche Konzentration haben.
Beispiel: Das Kupfer-Konzentrationselement
Das Potential zweier Kupferhalbzellen soll verglichen werden. Dazu nimmt man zwei Zellen mit dem Konzentrationsunterschied 1:10. Es werden zwei identische Kupferstäben verwendet.
Die notwendigen Kupfersulfatlösungen:
Lösung 1: 50ml Wasser werden zu 5g CuSO4 gegeben.
Lösung 2: 1/10 der Konzentration von Lösung 1
Eine Messung des Potentials ergibt eine Spannung von 0,031V (obwohl gleiche Metalle und in beiden Fällen eine Kupfersulfatlösung vorliegt)
Eine solche Anordnung (gleices Metall und gleicher Elektrolyt) nennt man "Konzentrationselement" bzw. "Konzentrationskette"
- Zwischen den beiden Halbzellen, welche das gleiche Element und die gleiche Elektrolytlösung enthalten und sich nur in der Konzentration der Elektrolytlösung unterschieden, bildet sich eine Spannung.
- Das Potential jeder Halbzelle ist dabei von der Konzentration der Salzlösung abhängig!
- Durch die Redoxreaktion kommt es zum Konzentrationsausgleich zwischen den beiden Halbzellen.
- Es gilt: Die schwächer konzentrierte Lösung ist die unedlere und somit der negative Pol (Anode - Ort der Oxidation).
Man kann mit diesem Wissen nun auch Konzentrationselemente mit verschiedenen Metallen herstellen.
Nernst und seine Gleichung
Walther Hermann Nernst (1864 - 1941) hat sich mit diesem Phänomen beschäftigt. Er wollte den mathematischen Zusammenhang dahinter finden. Er bemerkte, dass bei Spannungsmessungen mit Halbzellen gleicher einwertiger Elemente (so wie Ag+)eine Spannung von 0,059 V pro Zehnerpotenz Konzentrationsunterschied zwischen den Halbzellen gemessen wird. Sind die Ionen hingegen zweiwertig (so wie Cu2+), so ist die Spannung nur halbiert (0,0295 V).
Er stellte die nernstgleichung auf, welche in besonders in Schulen folgendermaßen vereinfacht wird:
0,059V c(ox)
ΔE (Red/Ox) = E0 (Red/Ox) + ———— · lg ———
1 c(red)
• n = Wertigkeit des jeweiligen Ions
• statt c(ox)/c(red) bzw. c(Anode)/c(Kathode)
• Der Faktor 0,059V ist ein Proportionalitätsfator bei Standardtemperatur 298K (=25°C) gilt.
• Anstelle von ΔE wird in manchen Büchern auch ΔU (für Spannung) oder EMK verwendet.
Vereinfachungen der Nernstgleichung:
Nernstgleichung für eine Metallhalbzelle bei 25°C:
0,059V c(Men+)
E = E0 + ———— · lg ——————
n 1 (mol/l)
(1 mol/l, als Vereinfachung für feste Metalle)
Nernstgleichung für eine Wasserstoffhalbzelle bei 25°C:
0,059V c(H+)
E = E0 + ———— · lg ——————
1 1 (mol/l)
Nernstgleichung für eine Nichtmetallhalbzelle bei 25°C:
Bei Nichtmetallen bildet in der Regel die reduzierte Form (und nicht die oxidierte wie bei den Metallen) das (An-)Ion.
0,059V 1 (mol/l)
E = E0 + ————— · lg ——————
n c(Anionn–)
Berechnung der Spannung von zwei Halbzellen in einer Konzentrationskette nach Nernst
Eselsbrücke für zwei Metallhalbzellen des gleichen Ions/Metalls: Die verdünntere Lösung ist die Anode (die oxidierte, unedlere Form), die konzentrierte Lösung ist die Kathode (also die reduzierte, edlere Form)!
Beachte: c(red)An und c(red)Kat sind in der Regel Metalle (elementare Form) und werden vereinfacht jeweils = 1 gesetzt!
0,059V c(ox)
E(Kat) = E0 (Red) + ———— · lg ————
n c(red)
0,059V c(ox)
E(An) = E0 (Ox) + ———— · lg ————
n c(red)
Die beiden Ergebnisse werden nun nach der folgenden Formel subtrahiert:
ΔE = E(Kathode) - E(Anode)
Anwendung der Nernst-Gleichung in drei Schritten
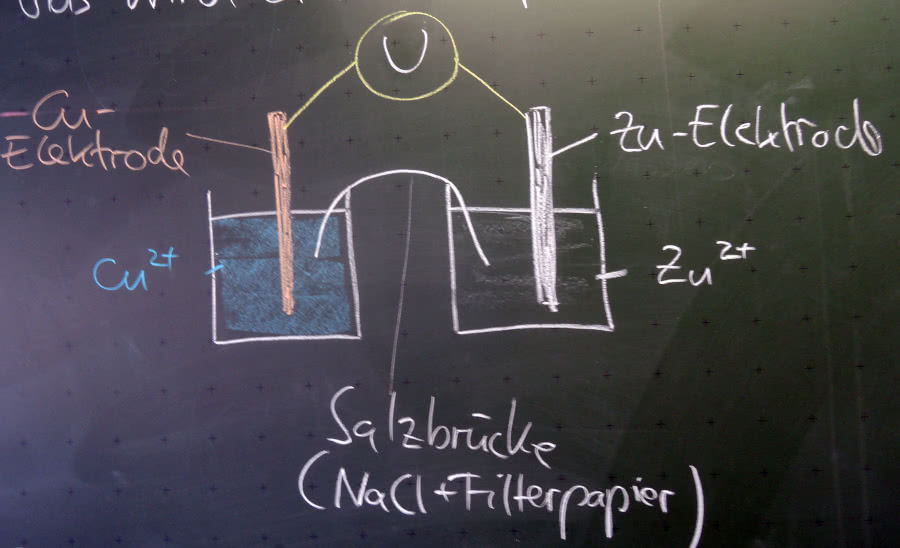
Die Spannung in einem Daniell-Element soll gemessen werden:
In dem Daniell-Element liegen die folgenden Konzentrationen vor:
c(Zinkionen) = 0,4 mol/l
c(Kupferionen) = 1·10-3 mol/l.
Bestimme die Spannung!
1. Reaktionsgleichung aufstellen und berechnen von ΔE für 1 molare Lösungen:
red: Cu2+ + 2e– ---> Cu E0 = 0,34V
ox: Zn ---> Zn2+ +2e– E0 = -0,76V
—————————————————————
Redox: Zn + Cu2+ ---> Cu + Zn2+
ΔE = E(Kathode) - E(Anode) = 0,34V - (-0,76V) = 1,1V
2. Berechnung der Spannungen der beiden Halbzellen:
0,059V c(ox)
EKat = E0Kat + ———— · lg ————— =
n c(red)
0,059V [Cu2+]
= 0,34V + ———— · lg ————— = 0,25V
2 [Cu]
[Cu] = 1, da es ein Feststoff ist
sowie:
0,059V c(ox)
EAn = E0An + ———— · lg ————— =
n c(red)
0,059V [Zn2+]
= -0,76V + ———— · lg ————— = - 0,77V
2 [Zn]
[Zn] = 1, da es ein Feststoff ist
Man setzt nun die beiden Teilergebnisse in die Gesamtgleichung:
3. Berechnung ΔE
ΔE = E(Kathode) - E(Anode) = 0,25V - (-0,77V) = 1,02V