Name: Sophie 2017-11
Löslichkeit von Salzen und Löslichkeitsgleichgewicht
Allgemeines zum Auflösen von Salzen
Im festen Zustand liegen Salze, aufgebaut aus Ionen, im sogenannten „Ionengitter“, einer festen Struktur, vor. Beim Lösen von Salzen in Wasser werden die Ionen mittels Wechselwirkungen mit den Dipolmolekülen aus dem Ionengitter entfernt.
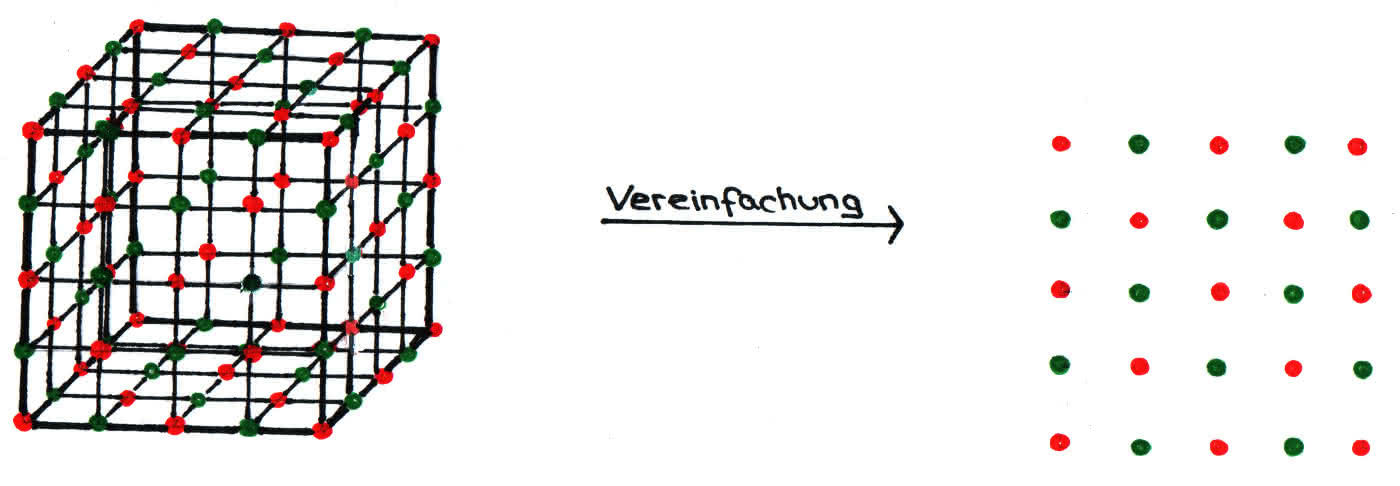
Aufbau des Salzkristall - Ionengitter im festen Zustand
Um die Anziehung zwischen negativen und positiven Ladungen zu überwinden, muss die sogenannte Gitterenergie/ -enthalpie aufgebracht werden. Um den Lösungsvorgang zu beenden, muss eine Hydrathülle um das jeweilige Ion entstehen, welche aus Wassermolekülen aufgebaut ist, die sich entsprechend ihrer Partialladungen um das jeweilige Ion legen. Dabei wird Hydratisierungsenergie/ -enthalpie freigesetzt, welche –im Gegensatz zur Gitterenergie- ein negatives Vorzeichen hat.
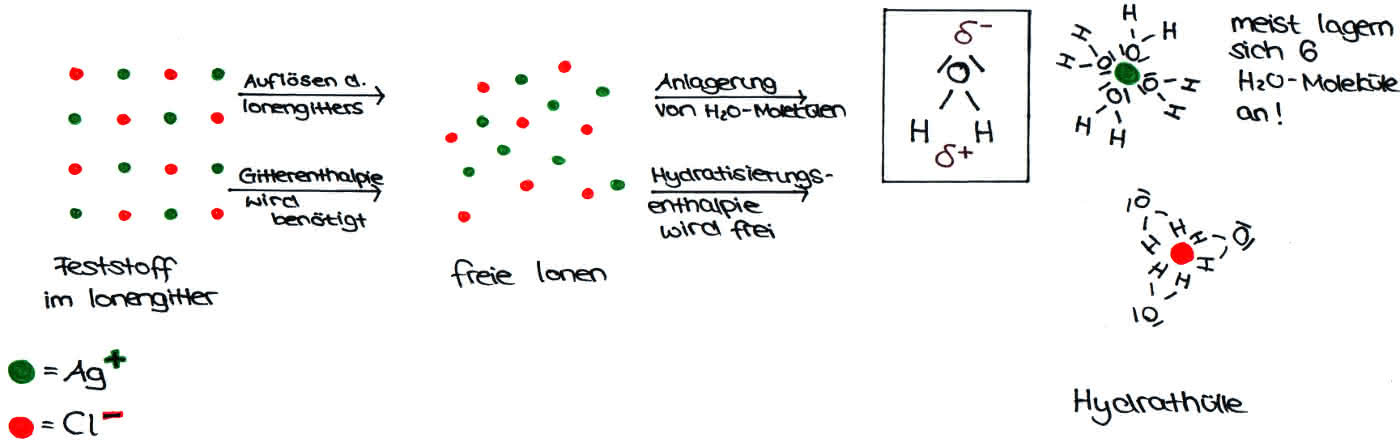
Ein Klick auf die Grafik vergrößert sie
Es gibt zwei energetische Möglichkeiten für den Lösungsvorgang:
- Ist der Energiebetrag der Hydratisierungsenergie größer als der der Gitterenergie, erwärmt sich die Lösung. Es handelt sich um einen exothermen Vorgang.
- Kühlt sich die Lösung hingegen ab, wurde mehr Gitterenergie benötigt, als die Hydratisierung freisetzt und der Vorgang ist endotherm.
Wenn das Lösen von Salzen endotherm verläuft, nimmt die Löslichkeit von Salzen mit steigender Temperatur zu (Das Prinzip des „kleinsten Zwangs“ von Henry Le Chatelier). Dies ist recht häufig der Fall.
Wird nicht genug Hydratisierungsenergie freigesetzt, um die hohe Gitterenergie bereitzustellen, kann das Ionengitter nicht zerstört werden. Das Salz ist schwerlöslich. Dies ist auch an einer Trübung erkennbar, wenn das schwerlösliche Salz als Feststoff ausfällt.
Das Löslichkeitsgleichgewicht
Es beschreibt "das thermodynamische Gleichgewicht zwischen Bodenkörper und einer gesättigten Lösung."
Es zeigt sich, dass bei gesättigten Lösungen, welche die maximale Anzahl an gelösten Ionen erhält, auch im Gleichgewicht ein stetiger Stoffaustausch zwischen Teilchen des Bodenkörpers und der Lösung stattfindet.
Der feste Bodensatz von Silberchlorid steht in ständigem Stoffaustausch mit den Ionen der Lösung:
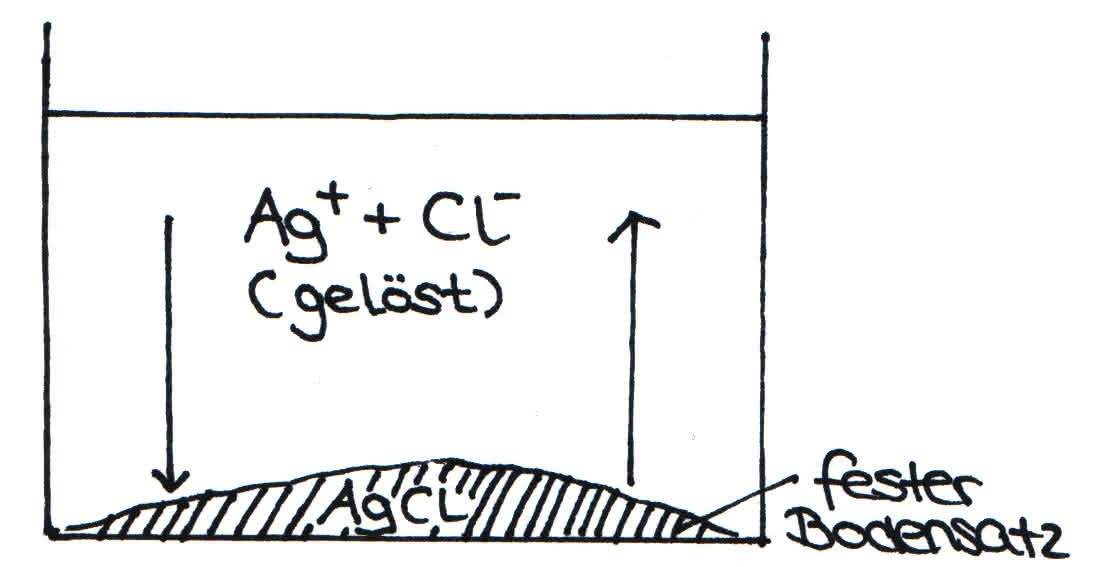
Löslichkeitsgleichgewicht zwischen gelösten Ionen und den ungelösten Ionen des Bodensatzes.
Auflösegeschwindigkeit = Kristallisationsgeschwindigkeit
Das Löslichkeitsprodukt für das gewählte Beispiel: KL = [Ag+]·[Cl-]
