Namen: Julian Fischer, Jakob Ulmer, David Jestedt, Jannis Pieschner
Namen:Maria, Nils, Max, Phillip
Die Metallbindung
1. Allgemeines
Metalle bzw. Legierungen (Schmelze von mehreren Metallen) haben nur wenige Valenzelektronen.
=> niedrige Ionisierungsenergie zum Entfernen der Elektronen vom Atomkern nötig.
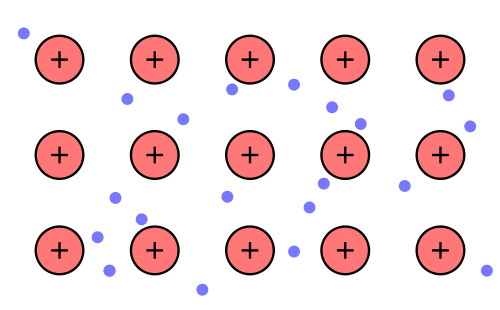
Es entstehen positive Atomrümpfe und Elektronen (negativ).
Quelle Bild: Public Domain by Wikipedia-User ARTE; http://commons.wikimedia.org/wiki/File:Nuvola_di_elettroni.svg
Definition Metallgitter:
Die positiven Atomrümpfe werden von den Elektronen zusammengehalten, die sich frei zwischen den Atomrümpfen bewegen können (delokalisiert).
denn: (positiv und negativ geladene Teilchen ziehen sich an!)
Diese frei beweglichen Elektronen nennt man auch Elektronengas, da sie sich wie Gas bewegen (Modellvorstellung) .
Definition Metallbindung:
Bei Metallen und Legierungen liegt im Gegensatz zur Ionenbindung (Kationen und Anionen) oder zur Elektronenpaarbindung Metallionen und Valenzelektronen der Metalle vor, da die Ionisierungsenergie bei Metallen niedrig ist. Man nennt es auch Elektronengas. (siehe Ionisierungsenergie, Elektronenaffinität und Elektronennegativität)
2. Erklärung der besonderen Eigenschaften von Metallen
Aus dem besonderen Aufbau der Metallverbindung resultieren verschiedene Eigenschaften. Zum Einen erklärt sie die besonderst gute Leitfähigkeit, da die Valenzelektronen frei beweglich sind, zum Anderen erklärt dadurch die Stabilität der Metalle, weil die Elektronen und die Metallkationen sich gegenseitig anziehen. Man kann dadurch auch die Verformbarkeit. Aufgrund der freibeweglichen Elektronen kann man die Metallionen verschieben, ohne dass sich das Umfeld ändert. Es bleibt negativ. Die Elektronen können auch Wärme gut leiten, da Wärme die Bewegung der Teilchen ist. Die Elektronen sind freibeweglich und können sich so gut sich gegenseitig anstossen. (Zum Vergleich mit Ionengitter und Elektronen-Paar-Bindung siehe die dazugehörigen Artikel.)
2.1 Wärmeleitfähigkeit
Bei Wärmezufuhr beginnen die Atome (und Elektronen) im Gitter zu schwingen. Sie stoßen sich dabei gegenseitig an (jeweils die Atome und jeweils die Elektronen). Wenn sie sich abstoßen wird die Wärme in Form von Bewegungsenergie weitergegeben. Bei hohen Temperaturen überwiegt die Energieübertragung durch die Atome; bei niedrigen die durch Elektronen.
2.1.1 Vergleich zu Ionengitter
Im Ionengitter können sich die Atome und Elektronen nicht so gut abstoßen wie im Metallgitter, da sich diese deutlich mehr anziehen und „zusammenhängen“ als im Metallgitter.
=> Metalle sind bessere Wärmeleiter als Ionenverbindungen
2.2 Elektrische Leitfähigkeit
Elektrische Leitfähigkeit ist nichts anderes als Bewegung von Elektronen vom negativen zu positiven Pol.
Wird an das Metall eine Spannung angelegt, passiert genau dies mit den Elektronen im Metall.Dies wird von der Struktur des Metallgitters begünstigt (kanalartig).
Metalle leiten bei hohen Temperaturen schlechter den elektrischen Strom als bei niedrigen, da die Atome bei erhöhter Energiezufuhr anfangen zu schwingen und somit den elektrischen „Fluss“ stören.
2.3 Verformbarkeit
Die Verformbarkeit ist dem Aufbau des Metallgitters geschuldet.Wenn das Gitter verschoben wird kommen die einzelnen Atome immer wieder in die selbe Umgebung (positive Atomrümpfe).
3. Metallgitter bei Legierungen
Legierungen sind mehrere miteinander verschmolzene Metalle.
=> ähnlicher Aufbau wie reine Metalle
Also ist das Metallgitter auch aus unterschiedlichen Atomrümpfen und Elektronen aufgebaut.Dies wirkt sich auch auf die Eigenschaften aus:
Man kann die Atomrümpfe nicht mehr untereinander verschieben sodass die Bindungen noch gut zusammenpassen.
=> schlechtere Verformbarkeit
Beispiel: Eisen ist gut verformbar und weich aber Stahl ist hart.
Die restlichen charakteristischen Eigenschaften von Metallen bleiben größtenteils erhalten.Andere Eigenschaften wie Dichte, Härte und Beständigkeit sind hiervon aber nicht beeinflusst und hängen von den einzelnen Chemikalien ab.
Legierungen
Legierungen sind aus mehreren verschiedenen Metallionen aufgebaut. Deswegen kann man Legierungen nicht sogut verformen, da die unterschiedliche Ladungen nicht zueinander verschoben werden können.(siehe Legierungen)