Name: Sophia H., 2015
Alex Hauke, 2018-01
Herstellung Schwefelsäure durch das Doppelkontaktverfahren
1. Wenn man die Sauerstoffsäure Schwefelsäure herstellen möchte, verbrennt man Schwefel (S) in reinem Sauerstoff (O2) in einem Verbrennungsofen. Daraus entsteht dann Schwefeloxid (SO2).
S + O2 --> SO2
2. Danach lässt man das Schwefeloxid, im Kontaktofen mit Sauerstoff oxidieren. Es entsteht Schwefeltrioxid. Um die nachfolgende Reaktion in Gang zu setzen, leitet man das Gasgemisch durch Horden (=Siebböden), die Katalysatoren enthalten (Katalysatoren sind Stoffe, die Reaktionen ermöglichen oder beschleunigen). Dabei entsteht der Feststoff Schwefeltrioxid.
2SO2 + O2 ⇌ 2SO3
3. In einen Absorber vermischt man nun das Schwefeltrioxid mit 96%iger Schwefelsäure (= leicht verdünnte Schwefelsäure). Da die leicht verdünnte Säure einen kleinen Wasseranteil besitzt, reagiert das Schwefeltrioxid mit diesem Wasseranteil. (Man gibt eine leicht verdünnte Schwefelsäure hinzu, weil man dadurch verhindert, dass Dischwefelsäure entsteht.)
SO3 + H2O -> H2O4
Die Konzentration des nun entstandenen Gemisches ist auf 99% angestiegen.
4. Da das Schwefeldioxid in dem ersten Kontaktofen (Schritt 2) nicht vollständig umgesetzt wird, wird im Doppelkontaktverfahren das übrige Schwefeldioxid nochmals über einen Zwischenabsorber durch eine Kontaktschicht geleitet und im 3. Absorber, dem Endabsorber das so entstandene Schwefeltrioxid in Schwefelsäure gelöst. Es entsteht eine mindestens 99.8%ige Schwefelsäure, durch diese modernen Anlagen.
Schwefeloxide sind Nichtmetalloxide und reagieren deshalb mit Wasser zu Säuren.
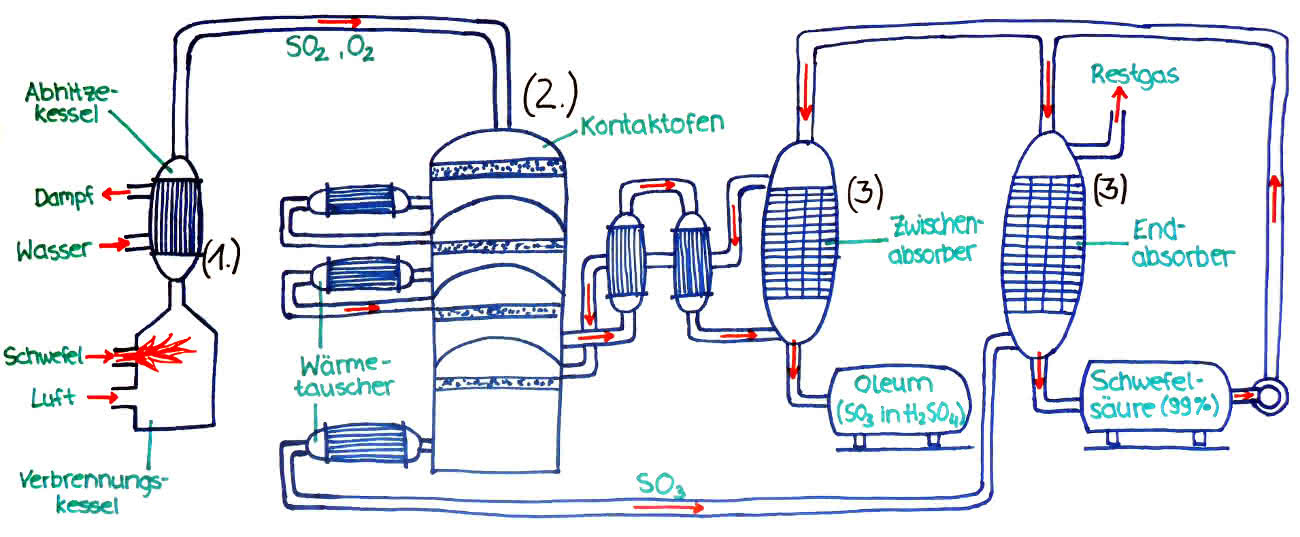
Schwefelsäureherstellung nach dem Doppelkontaktverfahren

Eigenschaften der Schwefelsäure:
- Die chemische Verbindung Schwefelsäure, H2SO4 ist eine farblose und ölige Flüssigkeit.
- Ihre Dichte beträgt 1,84 g/cm3.
- Sie schmilzt bei 10°C (Schmelzpunkt) und ihr Siedepunkt liegt bei 280°C.
- Die konzentrierte Schwefelsäure H2SO4 wirkt Wasser anziehen, verkohlend und oxidieren.
- In konzentrierter Form kann sie unter Bildung von Kohlenstoff organische Stoffe, wie Zucker, Baumwolle oder Haut zerstören.
- Konzentrierte Schwefelsäure spaltet aus Stoffen wie Holz und Papier Wasser ab.
- Ist sie heiß, kann sie Cu, Ag und Hg lösen.
- H2SO4 ist eine starke, zweiprotonige Säure in wässrigen Lösungen.
- Im Magen verursacht sie lebensgefährliche Verletzungen.
- Sie zieht aus der Luft Feuchtigkeit an (hygroskopisch).
- Sie ist einer der stärksten Säuren und ist sehr ätzend.
