Name: Valentin R., 2018-05
Hinweis für die Mittelstufenschüler: Ich verwende in diesem Artikel einen besonderen Reaktionspfeil, den sogenannten Gleichgewichtspfeil. Lasst Euch davon nicht irritieren und stellt Euch einen normalen Reaktionspfeil vor.
(Quantitaive) Neutralisation und Titration
Definition:
Die Neutralisation beschreibt den Vorgang, bei dem eine Säure mit einer Base zu Salz und Wasser reagiert.
Vorgang der Neutralisation:
Die Idee bei der Neutralisation ist es, die ätzenden Protonen (bzw. Oxoniumionen, also H3O+) mit den ätzenden Hydroxidteilchen (also OH-) so auszugleichen, dass unschädliches Wasser (also H2O) und das jeweilige Salz entsteht. Wenn die Neutralisation geglückt ist, zeigt der Universalindikator die Farbe grün an (=eine neutrale Lösung) und der pH-Wert liegt bei 7.
Beispiele für Neutralisationen:
Natronlauge und Salzsäure reagieren zu Wasser und Natriumchlorid:
NaOH + HCl ⇌ H2O + NaCl
Schwefelsäure und Kalilauge reagieren zu Wasser und Kaliumsulfat:
H2SO4 + KOH ⇌ 2 H2O + K2SO4
Phosphorsäure und Kalkwasser reagieren zu Wasser und Calciumphosphat:
2 H3PO4 + 3 Ca(OH)2 ⇌ 6 H2O + Ca3(PO4)2
Quantitative Neutralisation:
Sie beschreibt die mathematische Rechnung mit der man die nötige Volumina oder Konzentration bestimmt.
Erklärung Quantitative Neutralisation an einer Beispielaufgabe mit Natronlauge:
Für die Neutralisation von 50ml Schwefelsäure benötigt man 15ml Natronlauge mit der Konzentration 0,1mol/l. Bestimme die Konzentration der Schwefelsäure.
Wichtig:
Die Formel für die Konzentration muss uns bereits bekannt sein:
c = Konzentration; n = Stoffmenge; V = Volumen
n
c = —
V
Überlegung:
H+ + OH- ⇌ H2O
Wir wissen: Im Neutralpunkt gilt: gleiche Anzahl an H+ und OH-.
Daraus folgt: Stoffmenge Säure = Stoffmenge Lauge, also: nS = nL
n
Es gilt: c = — | · V
V
⇔ c · V = n
nS = nL
∧ ∧
cS · VS = cL · VL
Reaktionsgleichung aufstellen:
Schwefelsäure + Natronlauge ⇌ Wasser + Natriumsulfat
H2SO4 + 2NaOH ⇌ 2H2O + Na2SO4
gesucht: cS
=> 2·cS · VS = cL·VL |:Vs |:2
(Hier kommt die ·2 auf die Seite der Säure, da der Anteil an Säureteilchen 2mal so hoch ist wie der Anteil der Laugenteilchen --->2·nS = nL )
cL · VL
cS = ————
Vs · 2
Zum Schluss muss man noch die Werte einsetzten. (Lösung: cS= 0,015 mol/l)
Titration
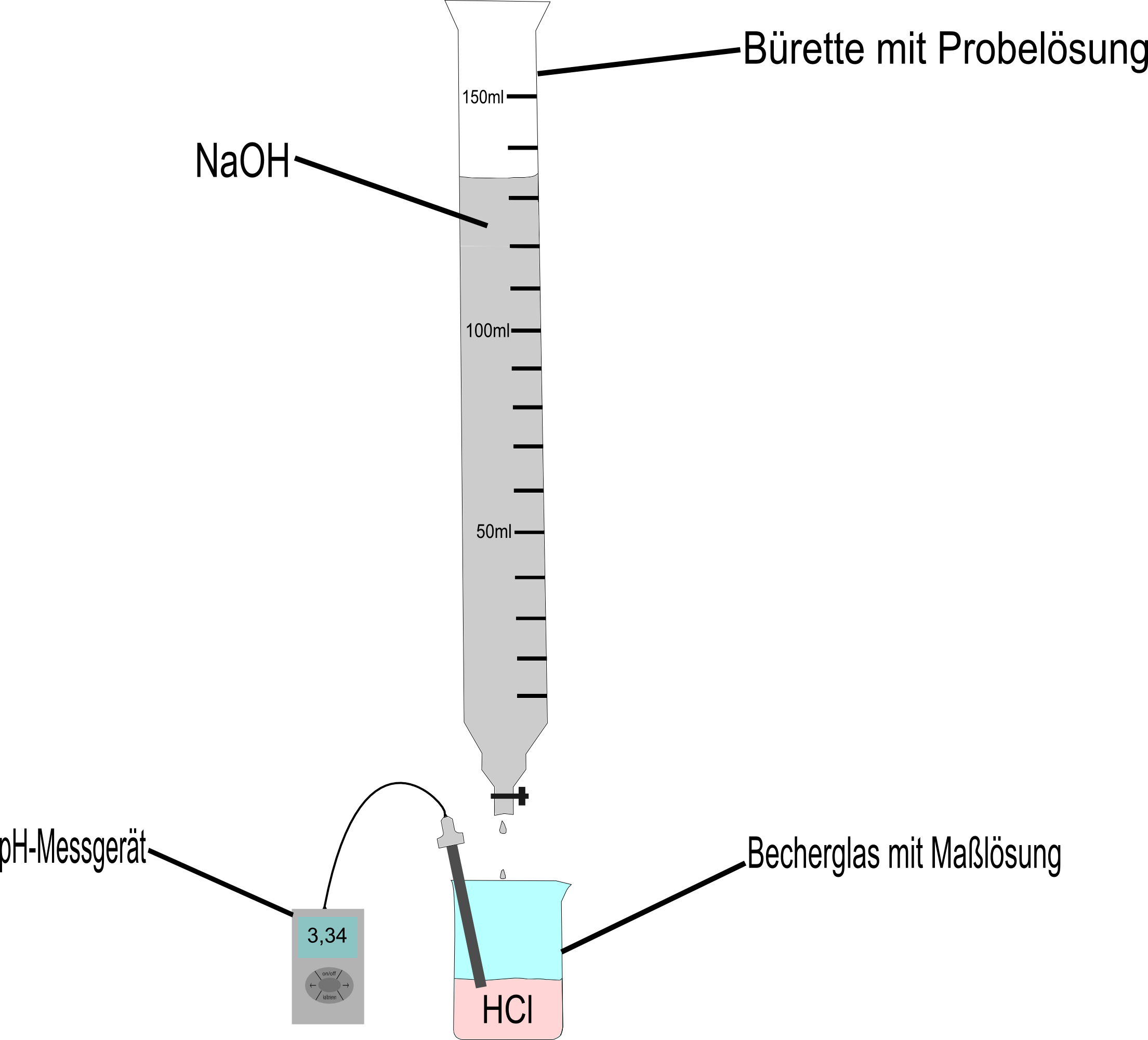
Eine Titration ist nichts anderes als eine Neutralisation zweier Stoffe durch exaktes Abmessen der zu neutralisierenden Stoffe in einem bestimmten chemischen Verfahren. Einen solchen Neutralisationsvorgang kann man zum Beispiel mit Salzsäure(HCl) und Natronlauge(NaOH) durchführen. Dabei wird die Säure (bzw. Lauge) in ein Becherglas gegeben und darauf Schritt für Schritt die Lauge (bzw. Säure) über eine sogenannte Bürette zugetropft.
Hält man nun ein pH-Messgerät in die Lösung im Becherglas oder färbt diese mit dem Universalindikator, so kann man beobachten wie sich der pH-Wert durch das Zutropfen der Lauge (bzw. Säure) langsam ändert.
An der Bürette lässt sich dabei ablesen, wie viel Milliliter zu der Lösung im Becherglas schon zugetropft wurden. In unserem Beispiel wurde die Lauge in die Bürette gefüllt. Ein Versuchsaufbau würde also wie folgt aussehen:
Hat die Lösung im Becherglas den pH-Wert 7 oder färbt der Universalindikator die Lösung grün, so ist diese neutral. Es gilt also Stoffmenge Säure = Stoffmenge Lauge, also: nS = nL.
Der einfache Aufbau einer Titrationsapparatur macht es möglich dieses Verfahren anzuwenden, um mit hoher Genauigkeit in kurzer Zeit die Konzentration eines bekannten Stoffes zu bestimmen.
Angenommen wir wollen die Konzentration einer Salzsäure herausfinden, so lässt sich diese bestimmen, indem wir eine Titration mit Natronlauge durchführen, deren Konzentration bekannt ist. Beispielsweise könnte die Natronlauge eine Konzentration von 1 mol/l haben. Nun geben wir zu einer bestimmten Menge der Lauge (zum Beispiel 100ml) genau so viel Säure hinzu, dass die Lösung neutral ist. Da wir wissen, dass im Neutralpunkt gilt (siehe oben):
Stoffmenge Säure = Stoffmenge Lauge, also: nS = nL können wir nun die Konzentration der zugegebenen Säure berechnen, da wir nS aus nL berechnen können und wir wissen, wie viel Milliliter der Säure hinzu gegeben werden mussten bis die Lösung neutral war(= VS). So lässt sich die Konzentration berechnen mit:
n
c = —
V
Beispielaufgabe:
Berechne die Konzentration einer Salzsäure von der 50ml benötigt wurden um 100ml einer 1 molaren( 1mol/l) Natronlauge zu neutralisieren.
Überlegung:
Im Neutralpunkt gilt nL=nS
---> nL = cL· VL= 1mol/l · 0,1l= 0,1mol = nS
nS 0,1mol
---> cS = —— = ——— = 2mol/l
VS 0,05l
Titrationskurve
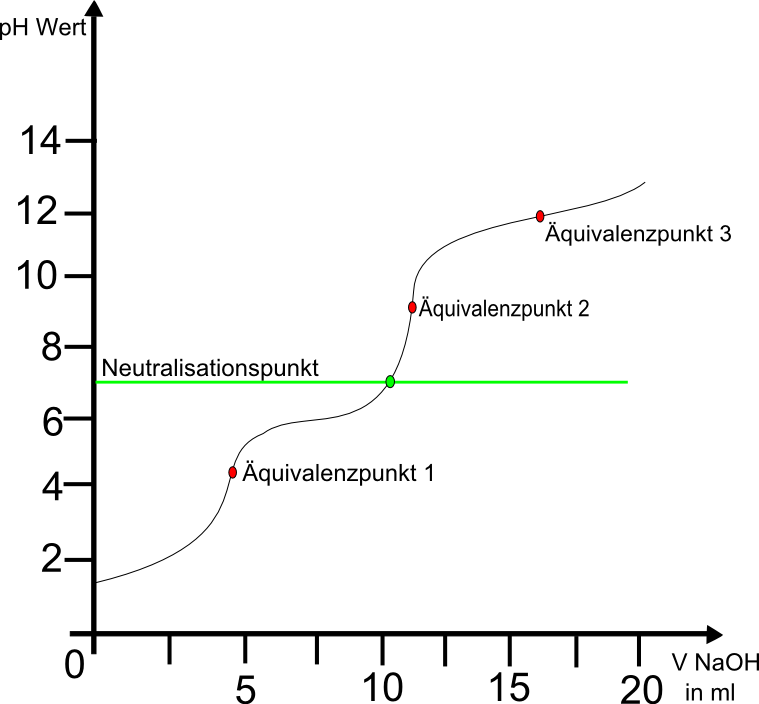
Zu jeder Titration lässt sich eine Titrationskurve erstellen. Eine solche Kurve kann wie folgt aussehen:
Die Titrationskurve ist ein Graph, der den pH-Wert der Neutralisationslösung in Abhängigkeit von der zugegebenen Base bzw. Säure angibt. An der beispielhaften Titrationskurve für die Neutralisation von 100ml 0,1molarer Salzsäure mit 1 molarer Natronlauge ist zu sehen, dass der pH-Wert der Salzsäure anfangs bei ca. 2 liegt nach der Zugabe von 20ml Natronlauge auf ca 13 steigt.
Deutlich wird eine starke Steigung in der Nähe von 10 ml Basenzugabe. Das liegt daran das dort der sogenannte Äquivalenzpunkt liegt. Bei diesem Punkt ist die Stoffmenge an Säure- und Baseteilchen gleich groß. Der Äquivalenzpunkt ist gleichzeitig der Wendepunkt der Titrationskurve. Hier schlägt die Lösung von der Säure zur Base um, weshalb nur wenige Tropfen der Natronlauge eine starke pH-Wertänderung ausmachen. Der Äquivalenzpunkt ist dabei nicht mit dem Neutralisationspunkt zu verwechseln. Bei der Reaktion einer starken Säure und Base liegt der Äquivalenzpunkt zwar annähernd auf dem Neutralpunkt (also bei pH=7), titriert man allerdings zwei unterschiedlich starke Säuren und Basen miteinander, dann ist der Äquivalenzpunkt nicht neutral. Das liegt daran, dass beispielsweise eine schwache Säure bei Anwesenheit einer starken Base schnell zum korrespondierenden Basenpaar reagiert und so selbst als Base in der Lösung vorliegt. Somit kann bei unterschiedlicher Stärke der Säure und Base der Äquivalenzpunkt vom Neutralpunkt abweichen.
Eine weitere Ausnahme bei der Titration bilden mehrprotonige Säuren, also solche mit mehr als einem Wasserstoff(Elementsymbol H) wie beispielsweise Phosphorsäure (H3PO4), Schwefelsäure (H2SO4) oder Kohlensäure (H2CO3). Da beispielsweise bei Phosphorsäure drei Säure-Base-Reaktionen ablaufen:
I H3PO4 + NaOH ---> H2PO4- + Na+ +H2O
II H2PO4- + NaOH ---> HPO42- + Na+ +H2O
III HPO42- + NaOH ---> PO43- + Na+ +H2O
Somit besitzt die Titrationskurve auch drei Äquivalenzpunkte: