Namen:
Hanna Richter, 2018-01
Irene Papendieck, 2018-01
Lena Niehues, 2021-06
Jonathan Jestädt, 2021-06
Luke Gras, 2021-06
Entstehung des Orbitalmodells (historischer Kontext):
Das Orbitalmodell basiert auf Entdeckungen im Bereich der Quantenmechanik durch die wichtigsten Atompysiker des 20. Jahrhunderts (wie Einstein, Schrödinger und Heisenberg). Das Orbitalmodell ist eine Weiterentwicklung des Bohr'schen Atommodells und wurde zu Beginn des 20sten Jahrhunderts entwickelt. Es beruht auf der Annahme, dass Elektronen Energiewellen sind, deren Aufenthaltsort man zu einem bestimmten Zeitpunkt zwar nicht genau angeben kann, aber mithilfe einer komplexen Gleichung, der Schrödingergleichung, Aufenthaltswahrscheinlichkeiten für Elektronen berechnen kann. Aus der Schrödingergleichung ergeben sich dann bestimmte Aufenthaltsbereiche für Elektronen. Diese Bereiche nennt man Orbitale.
Die Orbitale ersetzen die im Bohr'schen Modell festgelegten Schalen. Es gibt jedoch wesentliche Unterschiede:
- Es können sich in jedem Orbital höchstens 2 Elektronen befinden, die sich gegenläufig bewegen (das heißt, sie haben einen unterschiedlichen Spin).
- Es gibt verschiedene Orbitalarten, die sich in ihren Energieniveaus und in ihrer Form unterscheiden. Tatsächlich haben sie keine Form, sondern sie definieren nur den Bereich, in dem sich Elektronen zu 95% Wahrscheinlichkeit aufhalten. Die Orbitale haben also feste Grenze oder sind ein fester Gegenstand!
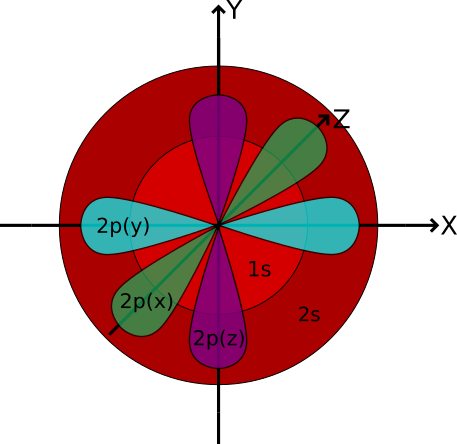
- Man unterscheidet die kugelförmigen s-Orbitale (Abb.1), die hantelförmigen p-Orbitale (Abb.2), d-Orbitale und f-Orbitale. Die Orbitale einer Art haben jeweils unterschiedliche räumliche Ausrichtungen (Abb.2).
Definition Orbital:
Ein Orbital bezeichnet in diesem Kontext den Aufenthaltsbereich, in dem sich die Elektronen eines Atoms mit sehr hoher Wahrscheinlichkeit befinden. Diese Bereiche stellen dabei die verschiedenen Lösungen der Schrödingergleichung dar und können jeweils nur maximal 2 Elektronen beinhalten, die sich in ihrem Spin unterscheiden (siehe Quantenzahlen).
Man unterscheidet zwischen den folgenden Orbitaltypen:
s-Orbitale (kugelförmig)
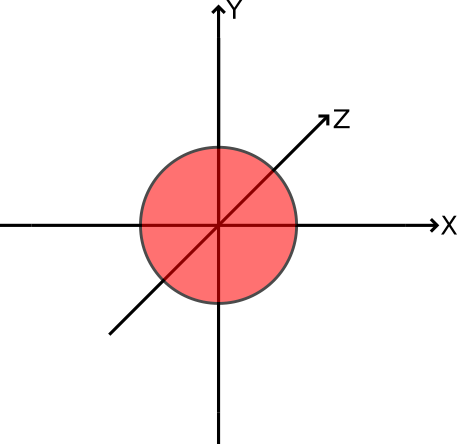
Abbildung 1: kugelförmiges s-Orbital
p-Orbitale (hantelförmig)
Die Elektronendichte konzentriert sich hierbei in zwei Regionen auf Seiten des Kerns. Man spricht bei diesen von sogenannten „Orbitallappen“. Jede Schale ab n=2 verfügt über drei p-Orbitale, die sich nur hinsichtlich ihrer räumlichen Ausrichtung unterscheiden.

Abbildung 2: hantelförmiges p-Orbital
d-Orbitale (verschiedene, komplexe Formen):
Ist die Hauptquantenzahl n größer oder gleich 3, sind d-Orbitale vorhanden. Jede Schale ab n=3 verfügt über 5 d-Orbitale. Hierbei haben diejenigen, in einer bestimmten Schale vorhandenen d-Orbitale verschiedene Formen und verschiedene Ausrichtungen.
f-Orbitale (verschiedene, komplexe Formen):
Ist n größer oder gleich 4, gibt es 7 äquivalente f-Orbitale.
Erklärung - Quantenzahlen:
Im Orbitalmodell wird zwischen 4 Quantenzahlen unterschieden:
| Die Hauptquantenzahl „n“ | (n∈N) | Energieniveau (entspricht Schale) |
| Nebenquantenzahl „l“ | l = n-1 | räumliche Form |
| Magnetquantenzahl „m“ | m= - l | räumliche Ausrichtung |
| Spinquantenzahl „s“ | s= +/- ½ | Eigenrotation |
Das Pauli-Verbot:
Das Pauli-Verbot besagt, dass in einem Atom keine zwei Elektronen vorhanden sein dürfen, die in allen 4 Quantenzahlen übereinstimmen.
Selbst die Elektronen, die in ihren ersten drei Quantenzahlen identisch sind (und somit in dasselbe Orbital gehören), müssen sich dann durch ihren Spin (vierte Quantenzahl) unterscheiden.
Die Hund’sche Regel:
Energiegleiche Orbitale werden zunächst nur einzeln mit Elektronen besetzt. Erst wenn alle energiegleichen Orbitale mit einem Elektron besetzt sind, folgt die „Spinpaarung“ bei der ein zweites Elektron mit entgegengesetztem Spin zum ersten hinzukommt.
Atombindungen:
Gehen Atome untereinander eine Verbindung ein, bei der ein Molekül entsteht, so spricht man von Atombindungen, die als Überlappungen der jeweiligen Orbitale aufgefasst werden können. Sie werden als Molekülorbitale bezeichnet.
Hybridisierung des Kohlenstoffs:
Ein Sonderfall liegt bei Kohlenstoff und der sogenannten Hybridisierung vor.
- C hat nur 6 Elektronen
- Nur 2 Orbitale enthalten ungepaarte Elektronen (letztlich einzeln besetzt – vgl. Hund’sche Regel) => Kohlenstoff wäre eigentlich zweibindig.
- Problem: Kohlenstoff ist eigentlich vierbindig
- Lösung: Hybridisierung des C-Atoms
- Annahme Kohlenstoff liegt in einem angeregten Zustand vor
- Erforderliche Energie: Anregungsenergie
- Prinzip: 2p(z)-Orbital (noch leer) wird mit einem Elektron aus dem 2s-Orbital besetzt
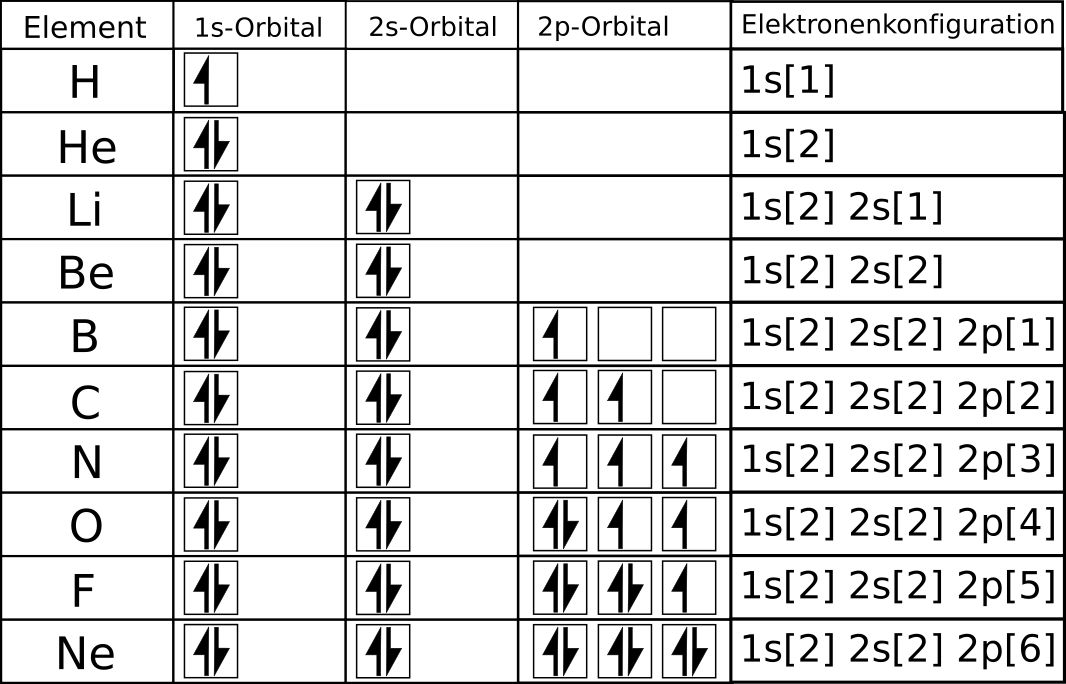
Darstellung der Elektronenverteilung - die Orbitalbesetzung:
Ein einfaches einzeichnen der Elektronen wäre viel zu unübersichtlich. Dies ist einer der Gründe, warum oft zur Erklärung das (leider falsche) Bohr'sche Atommodell immer noch unterrichtet wird. Anstelle dessen, kann man die Elektronen und ihre Elektronenkonfigurationen in einem sogenannten Kästchenschema darstellen.
Auf der X-Achse wird dabei das entsprechende Element aufgetragen, auf der Y-Achse das Energieniveau E. Ein Kästchen stellt ein Orbital dar, in dem die Pfeile der Anzahl und Richtung der Elektronen entsprechen.
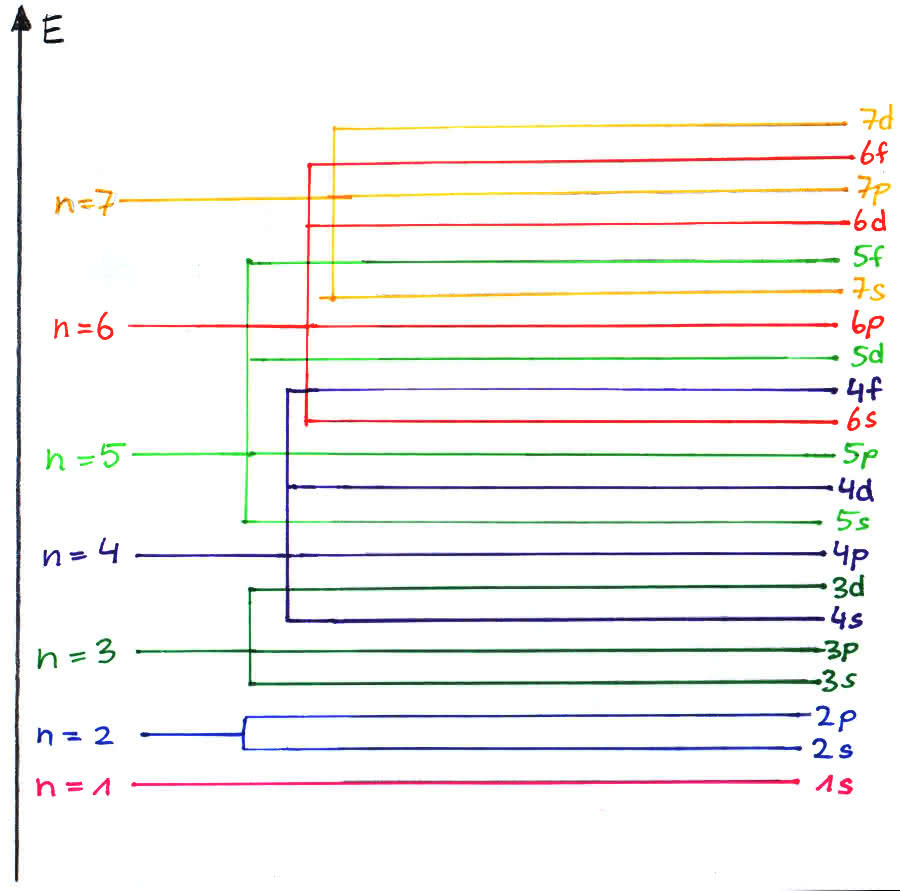
Die Anordnung der Elektronen erfolgt dabei nach dem folgenden Prinzip (energiebedingte Reihenfolge). Man beginnt zunächst damit, die energieärmsten Orbitale aufzufüllen und erst anschließend kommen neu eintretende Elektronen auf das nächsthöhere Niveau:
1s - 2s - 2p - 3s - 3p - 4s - 3d - 4p - 5s - 4d - 5p
Bemerkung: Das 4s-Orbital kommt vor dem 3d-Orbital, da ersteres energetisch „tiefer“ liegt - genauso verhält es sich mit dem 5s- und 4d-Orbital.
Regeln zu Besetzung der Elektroneniveaus
Zur Besetzung der Orbitale entsprechend der Energieniveaus gibt es mehrere Regeln:
- Es wird von unten (geringes Energieniveau) nach oben (also zu hohen Energieniveaus hin) besetzt. So wird das s-Orbitale immer innerhalb einer Periode das niedrigste Energieniveau haben. Es wird immer zuerst ein s-Orbital mit Elektronen besetzt. Das nächst höhere Energieniveau hat das 2s-Orbital. Danach folgt jedoch nicht das 3s-Orbital, sondern zunächst die drei 2p-Orbitale. In das 2s-Orbital und die 2p-Orbitale passen zusammen 8 Elektronen. Sie bilden das zweite Hauptenergieniveau, entsprechen also der 2. Schale des Bohrschen Atommodells.
Zum dritten Hauptenergieniveau gehören ein 3s-Orbital, drei 3p-Orbitale und fünf 3d-Orbitale. In der Anordnung sortiert nach Energieniveaus, liegt jedoch das 4s-Orbital noch unter den 3d-Orbitalen, d.h. es wird zunächst das 4s-Orbital aufgefüllt, bevor das erste 3d-Orbital mit Elektronen besetzt wird. Die Elemente, die hierbei entstehen, bilden die Nebengruppen, da sie vom ursprünglichen Schema abweichen.
Solche Übergrenzungen kommen mit steigendem Energievniveau immer häufiger vor. Das folgende Schema stellt dar, in welcher Reihenfolge die Orbitale aufgrund ihrer Energieniveaus besetzt werden.
Die genau Besetzungsreihenfolge zeigt die folgende Grafik:
- In jedes Kästchen dürfen nur 2 Elektronen
- die Elektronen eines Orbitals müssen einen unterschiedlichen SPin (also eine unterschiedliche Bewegungsrichtugn) haben. Die wird durch die unterschiedlichen Pfeilspitzen symbolisiert.
- Die Hund'sche Regel besagt, dass Orbitale mit gleichem Energieniveau immer gleichmäßig mit Elektronen aufgefüllt werden. Bevor man also Elektronen in einem Kästchen paart, werden erst die anderen besetzt.
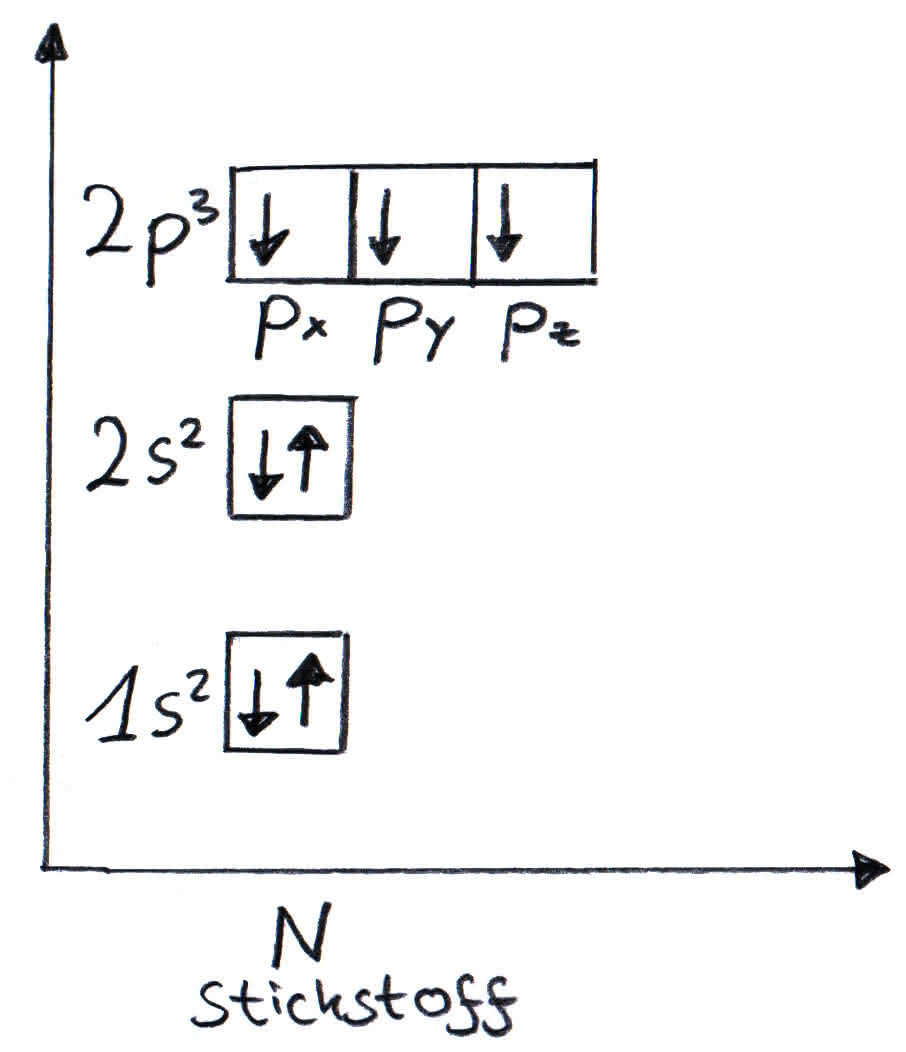
Elektronenverteilung im Kästchenschema für Stickstoff (7 Elektronen, die von unten nach oben besetzt werden)
Das 1s-Orbital entspricht der ersten Schale des Bohrschen Atommodells bzw. dem ersten Hauptenergieniveau und wird deshalb 1s-Orbital genannt. Helium würde im Kästchenschema also folgendermaßen aussehen:
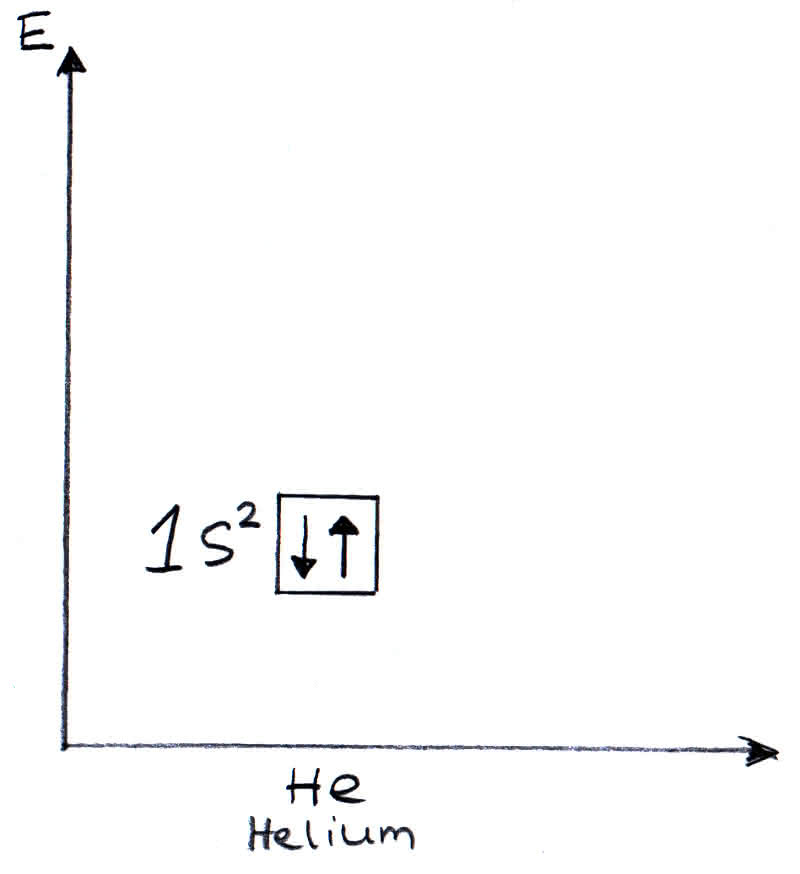
Elektronenverteilung im Kästchenschema für Helium
Das Orbitalmodell in Kästchenform:
- Pfeil => Elektron
- Kästchen => Orbital
Darstellung der Elektronenverteilung
Die Lektronenkonfiguration von Helium ist: 1s2
Die erste Zahl gibt sozusagen die Periodennummer, also das Hauptenergieviveau an. Der Buchstabe die Art des Orbitals und die hochgestellte Zahl über der Bezeichnung des Orbitals gibt an, wie viele Elektronen sich im jeweiligen Orbital befinden.
Die von Stickstoff (s.o.) ist: 1s2 2s2 2p3
Beziehung von Elektronenkonfiguration der Elemente und dem Periodensystem der Elemente
Das PSE:
Mit Hilfe des Periodensystems kann man erkennen, in welchem Orbital sich ein Elektron eines Elements befindet:
[Abbildung PSE]
Im Periodensystem kann man ablesen, in welchen Orbitalen sich die Elektronen eines Elements befinden.

Beispiel: Das Neon-Atom:
Neon besitzt 10 Elektronen und befindet sich im p-Block (Das 10. Elektron von Neon sitzt im p(z)-Orbital)
Man kann nun im Periodensystem ablesen, in welchen Orbitalen sich die anderen Elektronen befinden.
Die Elektronen besetzen immer das Orbital, in dessen Block sich das jeweilige Element mit der entsprechenden Ordnungszahl befindet.
Das erste und zweite Elektron von Neon befindet sich dementsprechend im 1s-Orbital, das dritte und vierte Elektron im 2s-Orbital, das fünfte und sechste im 2p(x)-Orbital, usw.
Elektronenverteilung Neon
Als weiteres Beispiel kann Blei dienen.
Elektronenkonfiguration von Blei
Insgesamt hat es 82 Elektronen, wie man an der Ordnungszahl erkennen kann. Blei befindet sich im p-Block (Abb.3), d.h. dass sich das "82. Elektron" in einem p-Orbital befindet. Wenn man den Ordnungszahlen in absteigender Reihenfolge folgt, kann man ablesen, in welchen Orbitalen sich die anderen Elektronen befinden, da sie immer das Orbital besetzen, in dessen Block sich das Element mit der entsprechenden Ordnungszahl befindet. Zum Beispiel besitzt das Element Thallium die Ordnungszahl 81 und befindet sich im p-Block, also befindet sich immer das "81. Elektron" (auch das von Blei) im p-Orbital. Wohingegen das Element mit der Ordnungszahl 80 im d-Block zu finden ist, das "80. Elektron" also immer ein d-Orbital besetzt.
So kann man also herausfinden in welchen Orbitalen sich die Elektronen eines beliebigen Elements befinden.
