Name: Aaron Tadesse, 2018-05
Die elektrochemische Spannungsreihe und Normalwasserstoffhalbzelle
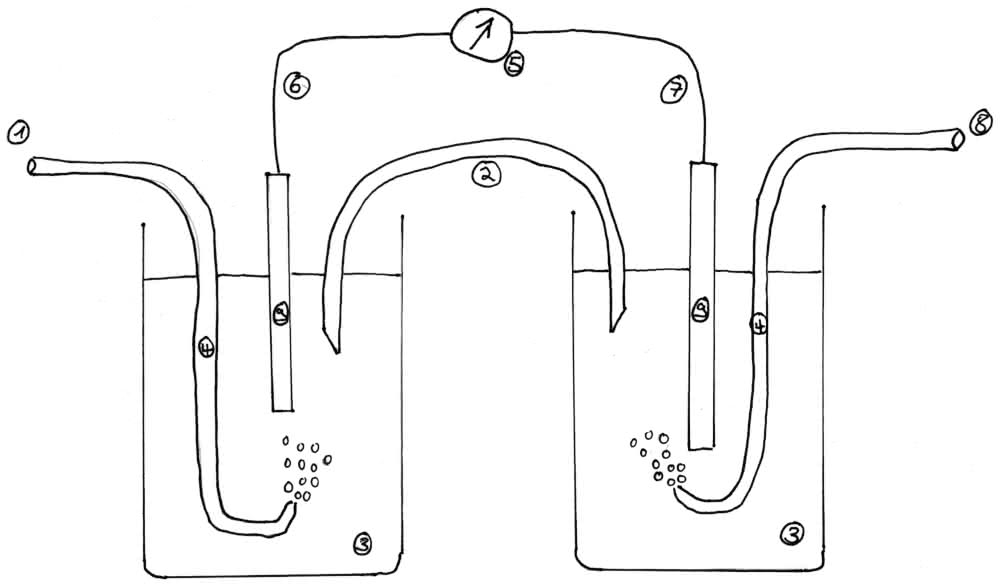
Auch mit Gasen kann man Redoxpotentiale messen.
Die linke Zelle ist hier eine Normalwasserstoffhalbzelle, die rechte misst das Potential von Chlor
Beschriftung:
1) Wasserstoff (mit p=1013 hPa)
2) Salzbrücke (meist NaCl)
3) verdünnte Salzsäure ( ca. 1 mol/L)
4)Gasleitungsrohr
5) Spannungsmessgerät (Einheit V/Volt)
6) - Pol (Anode)
7) + Pol (Kathode)
8) Chlor ( mit p=1013 hPa)
9) Elektrode (aus Platinblech/taucht in die Salzlösung ein)
{ads2}
Bei der Bestimmung der Spannung eines galvanischen Elements sind vor allem folgende Faktoren besonders wichtig: Elektrodenmaterial, verwendete Elektrolytlösungen (und deren Konzentrationen) und die Temperatur.
Ist ein Gas bei den chemischen Reaktion beteiligt, so ist das Potential auch vom Gasdruck abhängig. Aus diesem Grund ist es immer besonders wichtig, die Reaktionen unter Standardbedingungen ablaufen zu lassen, das heißt T=25°C, p= 1013hPa und c= 1mol/L für alle beteiligten Reaktionsstoffe.
Die Wasserstoffhalbzelle spielt hierbei eine ganz besondere Rolle. Hier halten sich bei der Reaktion von elentarem Wasserstoff zu Ionen (und umgekehrt) Oxidation und Reduktion in Waage.
H2 ⇌ 2H+ + 2e¯
Daher bildet sie die Bezugselektrode in der Elektrochemie. Gerade weil das Potential alleine nicht gemessen werden kann, ist diese internationale Übereinkunft relevant. Definitionsgemäß wird dieser Halbzelle auch das Standardpotential E0=0V zugeordnet. Alle anderen Halbzellen (wie zum Beispiel Chlor oben im Beispiel) beziehen sich auf diese Festlegung. Ist die zweite Halbzelle gegenüber der Standard-Wasserstoffhalbzelle die Donatorzelle, erhält ihr Standard-Elektrodenpotential ein negatives Vorzeichen und andersrum ein positives Vorzeichen. Aus den Standardelektrodenpotentialen lassen sich die Zellspannungen von den galvanischen Zellen berechnen. Folgende Gleichung gilt:
ΔE = E0 (Akzeptorhalbzelle) - E0 (Donatorhalbzelle)
Nun lassen sich weiterhin die Halbzellen mit anderen nichtmetallischen Redoxpaaren aufbauen und mit der Formel auch ihre Standard-Elektrodenpotentiale bestimmen. Im oben genannten Beispiel, bei dem die Standardwasserstoffhalbzelle mit der von Chlor zu einer galvanischen Zelle kombiniert wird, erhält man für das Redoxpaar Cl2/Cl- ein Standardelektronenpotential von 1,36 V.
Redoxpaare aus hydratisierenden Ionen, bei denen dasgleiche Element unterschiedlichen Oxidationszahlen vorkommt, nennt man homogene Redoxsysteme ( zum Beispiel Fe3+/Fe2+).
Wenn man die Redoxpaare nach ihren Standard-Elektrodenpotentialen sortiert, erhält man die so genannte Spannungsreihe. Diese gibt wichtige Informationen über den Verlauf von Redoxreaktionen in wässeriger Lösung, weil diese die Reduktions- und Oxidationswirkung der Redoxpaare beinhaltet.
Unter Standardbedingungen gibt das Reduktionsmittel des Redoxpaares mit dem kleineren (negativen) Standardpotential Elektronen an das Oxidationsmittel mit dem höheren (positiven) Standardpotential ab. Das in der Spannungsreihe weiter oben zu findende Reduktionsmittel reduziert immer das tiefer stehende Oxidationsmittel (Bergab-Regel).
Je kleiner das Standardpotential ist, desto stärker reduzierend wirkt das Redoxpaar und je größer das Redoxpotential ist, desto stärker oxidierend wirkt das Redoxsystem.
So ist zum Beispiel das Alkalimetall Lithium das stärkste Reduktionsmittel mit E0=-3,04 V und Halogen Flur das stärkste Oxidationsmittel mit E0=2,85 V.
Weiterhin lassen sich mit einer Spannungsreihe auch Aussagen darüber treffe, wie edel beziehungsweise unedel bestimmte Stoffe sind.
Bild 2 zeigt Auszüge aus einer solchen Spannungsreihe:

