Name: Kaffo, Naomie 2022-01
Was ist eigentlich Phosphorsäure?
Phosphorsäure (H3PO4) ist eine wichtige dreiprotonige, anorganische Säure und reagiert als mittelstarke Säure im ersten Schritt der Dissoziation. Die Phosphorsäure ist eine Säure des Elements Phosphor. Dies erkennt man daran, dass die Säuregruppe mit einem Phosphoratom (P) verbunden ist. Im ersten und zweiten Schritt der Protolyse wird die Phosphorsäure zum Ampholyten und kann sowohl Protonen abgeben als auch Protonen aufnehmen so wird sie zur Base oder zur Säure abhängig vom Reaktionspartner.
Da die Phosphorsäure wie man es dem Namen entnehmen kann, eine Säure ist, kann sie mit einer Base wie Natronlauge neutralisiert werden.
Bevor wir in der Protolyse der Phosphorsäure einsteigen, wollen wir uns erstmal anschauen was die Protolyse im Allgemeinen ist.
Bei der Protolyse handelt es sich um Protonenübertragung, soll heißen, dass ein Proton (H+) von einem Reaktionspartner auf den anderen übertragen wird. Die Protolyse ist ein wichtiger Vorgang zwischen Säuren und Basen nach der Brönsted´schen Säure-Base-Theorie.
Hierbei überträgt der Protonendonator, also die Säure, ein Proton auf seinen Reaktionspartner. Die Base nimmt diesen Proton als Protonenakzeptor auf. So stellt sich ein chemisches Gleichgewicht ein.
Protolyse von Phosphorsäure in Reaktionsgleichungen
Phosphorsäure ist eine dreiprotonige Säure, weshalb die Dissoziation in drei Schritten erfolgt. Dies bedeutet, dass die Phosphorsäure in jedem jeweils ein Proton abgibt bis alle drei Protonen abgegeben wurden.
Im ersten Protolyse Schritt kommt es zur Bildung von Dihydrogenphosphat-Ionen (ein Ampholyt). Die Reaktionsgleichung sieht folgendermaßen aus:
H3PO4(aq) + H2O(l) → H3O+(aq) + H2PO4-(aq)
Reaktionsgleichung in Worten:
Phosphorsäure und Wasser reagieren zu Oxonium- und Dihydrogenphosphat-Ionen.
Im zweiten Schritt der Protolyse bilden sich Hydrogenphosphat-Ionen (ein Ampholyt), somit ergibt sich folgende Reaktionsgleichung:
H2PO4-(aq) + H2O(l) → H3O+(aq) + HPO42-(aq)
Reaktionsgleichung in Worten:
Dihydrogenphosphat-Ionen und Wasser reagieren zu Oxonium- und Hydrogenphosphat-Ionen
Im letzten Schritt der Protolyse kommt es zu Phosphat-Ionen-Bildung
Die Reaktionsgleichung sieht wie folgt aus:
HPO42-(aq) + H2O(l) → H3O+(aq) + PO43-(aq)
Die Reaktionsgleichung in Worten:
Hydrogenphosphationen + Wasser ---> Oxonium + Phosphationen
Nun wollen wir uns diese Protolyse genauer anschauen, indem wir einen Blick in die Titration von Phosphorsäure werfen:
Was ist eine Titration und was genau hat es mit der Titrationskurve auf sich?
Eine Titration ist ein Verfahren der quantitativen Analyse in der Chemie. In diesem speziellen Fall handelt es sich um eine pH-metrische Titration. Ein bekannter Stoff, also Phosphorsäure, dessen Konzentration unbekannt ist, wird in einer gezielten chemischen Reaktion (hier: Protolyse) mit einer Maßlösung umgesetzt. das Ziel dieser Titration ist das Bestimmen der Konzentration der Phosphorsäure.
Zum Durchführen des Versuchs wird nach jeder Zugabe des Titriermittels der pH-Wert gemessen. Die Titrierlösung wird solange hineingetropft bis sich der pH-Wert fast nicht mehr ändert. die gemessenen Werte aus den pH-Werten und dem Volumen der Titrierlösung werden anschließend in ein Diagramm eingetragen.
Daraus ergibt sich schließlich eine Titrationskurve. Diese Titrationskurve ist in diesem Fall das Ergebnis einer Säure-Base-Titration.
Mithilfe der gemessenen Werten, also dem pH-Wert und dem Volumen der Titrierlösung, kann die Konzentration der Phosphorsäure schließlich berechnet werden.
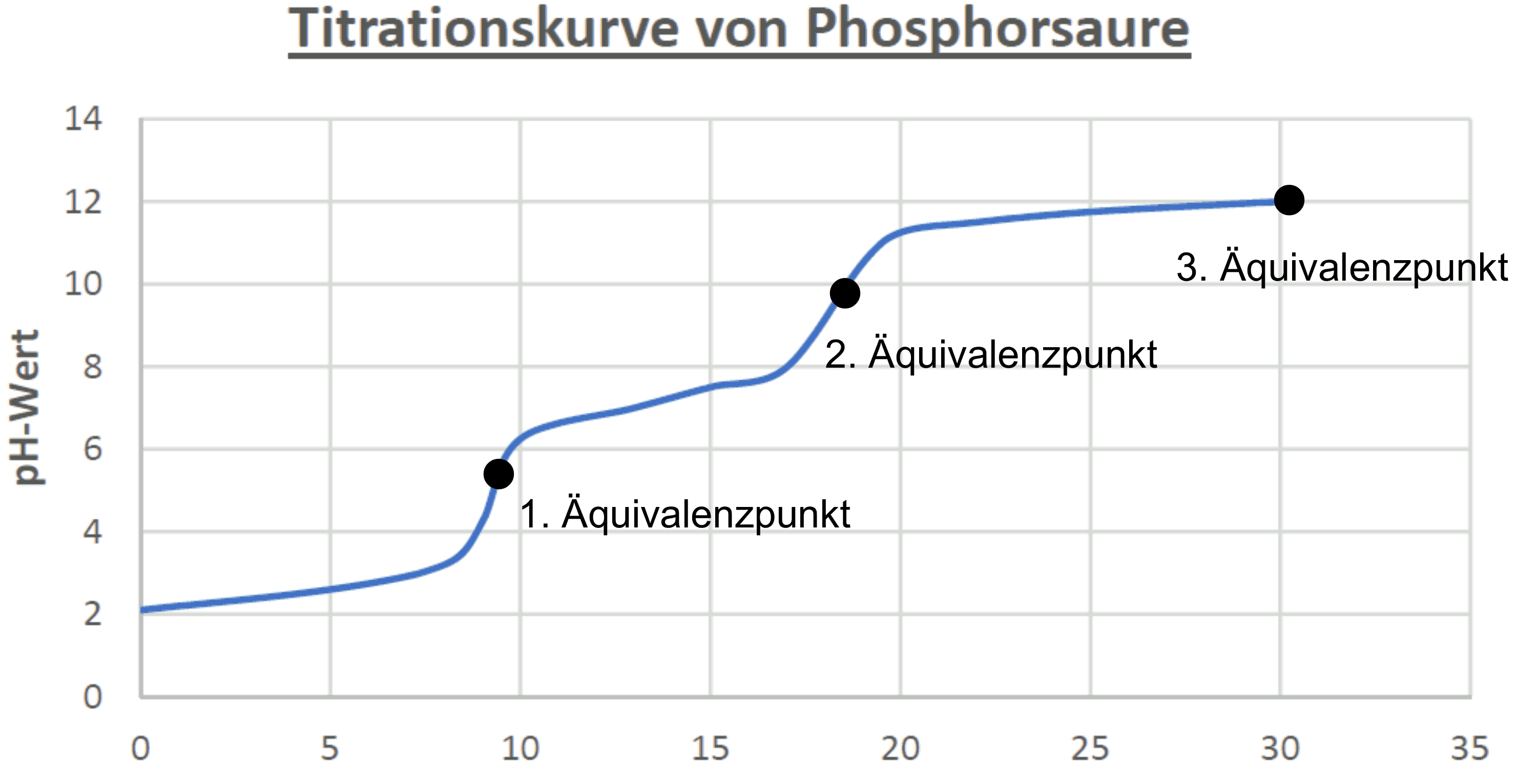
Auswertung der Titrationskurve
Zu Beginn der Titration beträgt der pH-Wert der reinen Phosphorsäure-Lösung 1-2. Durch die Zugabe von Wasser nimmt die Konzentration der Hydroxid-Ionen ab während die Konzentration der Dihydrogenphosphat-Ionen zunimmt. Bei einem pH-Wert von ca. 4,5 ist die Phosphorsäure fast vollständig in Dihydrogenphosphat-Ionen überführt. So liegen am ersten Äquivalenzpunkt, wo die Säure genauso viele Protonen abgibt wie die Base aufnimmt, überwiegend Dihydrogenphosphat-Ionen vor.
Mit der Hilfe von pH-Wert-Sprüngen kann man die Äquivalenzpunkte ausmachen.
Durch weitere Zugabe von Wasser nimmt die Konzentration der Hydroxid-Ionen weiter ab und es kommt schließlich zur Bildung von Hydrogenphosphat-Ionen. Der zweite Äquivalenzpunkt befindet sich ungefähr bei einem pH-Wert von 9, wenn vorwiegend nur noch Hydrogenphosphat-Ionen vorliegen.
Der letzte Protolyseschritt spielt erst bei pH-Werten oberhalb von 10 eine wichtige Rolle.
Eine letzte Wasser-Zugabe sorgt dafür, dass die Hydrogenphosphat-Ionen durch die abnehmende Konzentration von Hydroxid-Ionen so gut wie komplett in Phosphat-Ionen überführt werden. Der letzte Äquivalenzpunkt liegt daher bei pH-Wert 12 und stellt das Ende der Protolyse von Phosphorsäure, die fast vollständig in Phosphat-Ionen überführt wurde, dar.