Name: Thomas Beier und Falk Lindemann, 2012-11
Änderungsdatum: 2014-01
Aminosäuren
Als Aminosäuren wird eine Klasse organischer Verbindung mit mindestens einer Carboxylgruppe (–COOH) und einer Aminogruppe (–NH2) bezeichnet, die sich in deren chemischen Struktur unterscheiden.
Alle Aminosäuren bestehen aus mindestens zwei Kohlenstoffatomen. Die wichtigsten Aminosäuren haben eine endständige Carboxygruppe und in direkter Nachbarschaft die Aminogruppe.
Der Begriff "Aminosäuren" wird oft vereinfachend für sogenannte "proteinogene Aminosäuren" verwendet. Diese sind die Bausteine sämtlicher Proteine allen Lebens auf der Erde. 20 der proteinogenen Aminosäuren können durch Codons (Basentripletts) in der DNA verschlüsselt werden. Man bezeichnet sie als Standard- oder kanonische Aminosäuren. Zur Benennung der den Basentripletts zugeordneten Aminosäure zieht man die Codonsonne zu Hilfe.
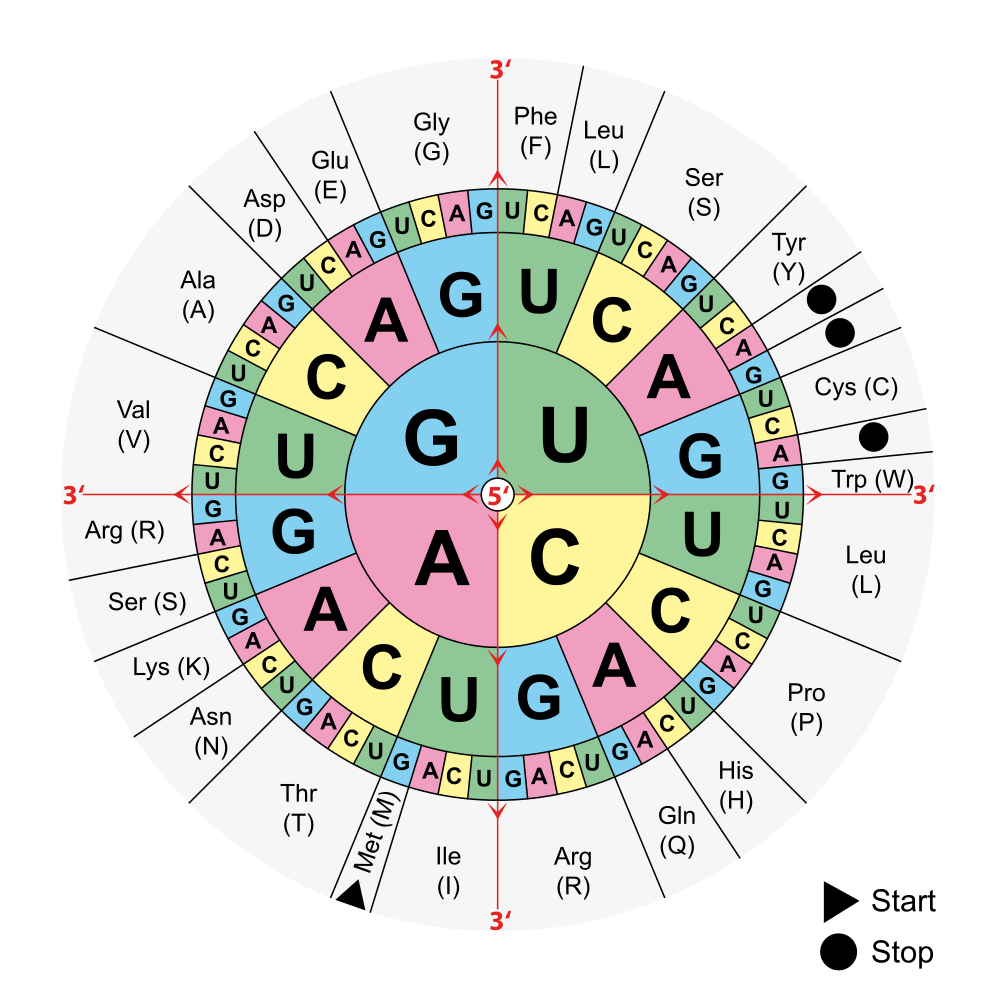 Lizenz: public domain by Wikicommonsuser Mouagip; http://commons.wikimedia.org/wiki/File:Aminoacids_table.svg
Lizenz: public domain by Wikicommonsuser Mouagip; http://commons.wikimedia.org/wiki/File:Aminoacids_table.svg
(Achtung: Es wird immer die komplementäre mRNA des DNA - Tripletts zum Ablesen benutzt! Siehe auch Transkription/Translation)
Aminosäuren, die vom tierischen Organismus nicht selbst hergestellt, also über die Nahrung aufgenommen werden müssen, heißen essentielle Aminosäuren (z.B. Valin, Methionin, Leucin, Isoleucin, Phenylalanin, Tryptophan, Threonin und Lysin)
Zudem gibt es noch semi-essentielle Aminosäuren, die nur in bestimmten Situationen (Wachstum, Verletzung) benötigt werden und auch über die Nahrung in den Körper gelangen. Die anderen Aminosäuren können direkt synthetisiert oder durch Modifikation anderer Aminosäuren gewonnen werden. Cystein kann z.B. aus der essentiellen Aminosäure Methionin synthetisiert werden. Hühnereier erhalten übrigens alle der vom Menschen benötigten essentiellen sowie semi-essentiellen Aminosäuren. Ausnahme:die kanonische Aminosäure Prolin besitzt, im Gegensatz zu den anderen kanonischen Aminosäuren, keine primäre, sondern eine sekundäre Aminogruppe, und wird daher auch als sekundäre Aminosäure, fälschlicherweise bzw. veraltet oft auch als Iminosäure,
bezeichnet.
Nicht essentielle Aminosäuren:
- können vom Körper selbst synthetisiert werden, z.B. Alanin, Asparaginsäure
- eine Verknüpfung von Aminosäuren ist unter H2O-Abspaltung (Kondensation) möglich
- auch weitere Verknüpfungen mit Aminosäuren sind möglich, so können beispielsweise Peptidbindungen entstehen, welche sehr stabil sind
Peptidtypen:
- Dipeptid: 2 AS miteinander verbunden
- Tripeptid: 3 AS miteinander verbunden
- Tetrapeptid: 4 AS miteinander verbunden
- Oligopeptid: ab 5 - 50/100 AS
- Polypeptide: ab 50/100 = Proteine
Aminosäuren sind essentiell für sämtliche Lebewesen, denn sie bilden:
Proteine
(Der Begriff Protein kommt vom griech. proteios: grundlegend (1838 von J.J. Berzelius))
Proteine (oder auch Eiweiße) sind die Basis der Genetik, man findet sie in allen Zellen. Sie verleihen der Zelle unter anderem Struktur (Stabilität, "Skleroproteine"), haben aber auch viele andere Aufgaben. Dazu gehören zum Beispiel der Metabolit-Transport, die Wirkung als Ionenpumpen (mehr dazu unter "Cytologie: aktiver und passiver Transport"), die Katalyse von chemischen Reaktionen und die Erkennung von Signalstoffen (siehe Cytologie).
Folgende Übersicht zeigt den Aufbau der Proteine aus Aminosäuren und deren unterschiedliche Strukturen:
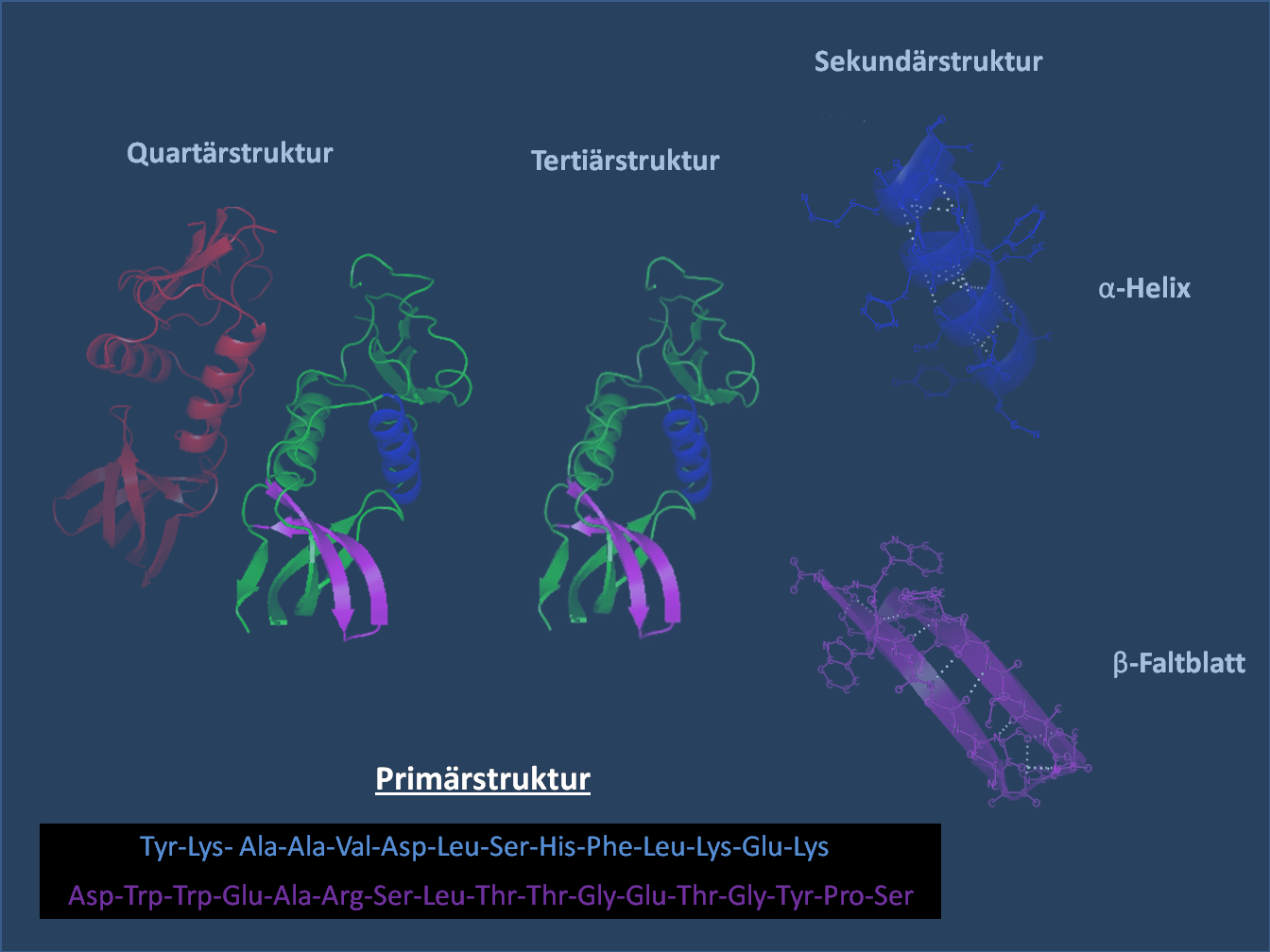
Lizenz: Creative Commons Attribution-Share Alike 3.0 Unported by Wikicommonsuser Holger87; http://commons.wikimedia.org/wiki/File:Protein-Primärstruktur.png
1. Primärstruktur:
- Abfolge der Aminosäuren
-> unterschiedliche AS sind miteinander verbunden
2. Sekundärstruktur:
- bedingt durch Wasserstoffbrückenbindungen zwischen den polaren Gruppen (-COO- und -NH2)
- Unterscheidung unter anderem in die α-Helix- und die β-Faltblatt-Struktur
- während eine α-Helix nur Wasserstoffbrückenbindungen von aufeinanderfolgenden Aminosäuren umfasst, bilden sich β-Faltblatt-Strukturen zwischen zwei oder mehreren begrenzten Abschnitten aus
3. Tertiärstruktur
- dreidimensionale Struktur
- Wechselwirkungen zwischen den Resten
- Wasserstoffbrückenbindungen: zwischen den polaren Aminosäuren
- Van der Waals-Wechselwirkungen: zwischen den unpolaren Aminosäuren
- Ionenbindung: zwischen den sauren und basischen Aminosäuren
- kovalente Bindungen: Disulfidbindungen -> zwischen Cysteinen feste, stabile Bindung
- Raumstruktur -> fertige Polypeptidkette
4. Quartärstruktur
- Zusammenlagerung mehrerer Polypeptidketten, die oft über Metallatome/-ionen stabilisiert sind
Aufgrund ihrer mannigfaltigen Aufgaben und Fähigkeiten wäre Leben auf der Erde ohne Proteine kaum möglich!
Proteine fungieren beispielsweise als:
- Schutz:
- gegen Toxine und Antikörper - Strukturgeber:
- Kollagene in Haut, Körper und Knochen; Muskelaufbau, Keratinbildung (z.b.Haare) sowie Seidenfäden bei Tieren (Spinnen,Insekten) - Stoffumsetzer(Metabolismus):
- Transport- und Signalfunktion: aktiver und passiver Transport, Blutgerinnungsfaktoren oder auch Hormone - Reservestoff:
- Energiegewinnnung bei Hunger durch Abbau der Aminosäuren
Gefahren für den Organismus: Denaturierung der Proteine
- Chemische Einflüsse wie zum Beispiel Säuren, Salze oder organische Lösungsmittel oder physikalische Belastungen wie Druck oder hohe/niedrige Temperaturen können die Sekundär- und Tertiärstrukturen der Aminosäuren und damit den räumlichen Aufbau der Proteinmoleküle verändern. Deshalb können denaturierte Proteine und Enzyme ihre Funkionen meist nicht mehr korrekt ausführen, was schwere oder gar tödiche Konsequenzen für einen Organismus haben kann.
- Der menschliche Körper macht sich die Eigenschaft zu nutze, um Antigene (Fremdkörper) unschädlich zu machen. Dies ist möglich, da deren Proteine meist bei niedrigeren Temperaturen denaturieren, als die körpereigenen des Menschen.
- Denaturierungen lassen sich nicht ohne Hilfe wieder rückgängig machen. Bekanntes Beispiel dafür ist das Eiklar eines rohen Hühnereies. Durch Kochen wird es fest (die räumliche Struktur hat sich geändert). Dieser Vorgang lässt sich nicht umkehren. Die künstliche Wiederherstellung eines Proteins nennt man Renaturierung.
