Namen:
Lorena Z.,
Sema Bach, 2017-01
Aldehyde
Aldehyde sind Carbonylverbindungen, die durch die Oxidation eines primären Alkohols entstehen. Aldehyde kann man im Gegensatz zu Ketonen noch weiter zur Carbonsäure oxidieren. Dies hängt daran, dass der Kohlenstoff der Carbonylgruppe nur mit einem weiteren Kohlenstoff verbunden ist (primäre Carbonylgruppe). Die Kohlenstoffe der Keton-Carbonylgruppen haben zwei benachbarte Kohlenstoffe, somit stellen diese eine sekundäre Carbonylgruppe dar. Der systematische Name lautet Alkanale. Aldehyde erhalten die Namen von denen Alkanen, welche mit der Anzahl der Kohlenstoffe mit der der Aldehyde übereinstimmt, dazu wird die Endung "-al" angehängt.
Die Carbonylgruppe R-C=O des Aldehyds hat neben dem Kohlenstoffsubstituenten auch noch einen Wasserstoffsubstituenten, was das Aldehyd vom Keton unterscheidet. Die funktionelle Gruppe ist somit (vereinfacht) -CHO.


Die Elektronegativitätsdifferenz zwischen dem Carbonylsauerstoff- und dem Carbonylkohlenstoffatom führt zu einer stark polaren Doppelbindung; diese sorgt für die Wirkung von Dipol-Dipol-Kräften zwischen den einzelnen Aldehydgruppen. Es können aber keine Wasserstoffbrückenbindungen ausgebildet werden, da an dem Carbonylsauerstoffatom kein positiv polarisiertes Wasserstoffatom gebunden ist. Dadurch ist die Siedetemperatur höher als die der Alkane (Van-der-Waals-Wechselwirkungen), aber niedriger als die der Alkanole/ Alkohole (Wasserstoffbrückenbindung). Die hohe Polarität der Kohlenstoff-Sauerstoff-Verbindung mit der positiven Ladung am Kohlenstoff und der negativen Ladung am Sauerstoff ist eine gute Vorlage für nukleophile Angriffe (zum Beispiel die nukleophile Addition).
Kurzkettige Aldehyde sind aufgrund der freien Elektronenpaare des Sauerstoffes der Carbonylgruppe gut wasserlöslich, denn die polarisierte Aldehydgruppe ist negativ geladen und bildet mit dem kurzen Rest der Kohlenstoffkette einen Dipol.
Dagegen sind langkettige Aldehyde schlecht wasserlöslich oder wasserunlöslich, da der Effekt der unpolaren Kohlenstoffkette des Aldehyds überwiegt.
Vorkommen und Verwendung
In der Natur sind die Aldehyde Bestandteil vieler Düfte und Aromen außerdem sind alle Zucker Aldehyde oder Ketone (Aldose oder Ketose). Alkanale werden aber auch durch ihre gute Reaktionsfähigkeit (in Gegenwart von Wasser) zu weiteren Produkten verarbeitet. Das Methanal, auch Formaldehyd genannt, besitzt hierbei in der chemischen Industrie und in der Kosmetik das größte Interesse, da es sowohl als Ausgangsstoff in der chemischen Industrie als auch in der Kosmetik genutzt werden kann, z.B. als Kunststoff, Desinfektionsmittel, Basisbestandteil vieler Parfüme und als Konservierungsmittel in diversen Kosmetika. Formaldehyd ist jedoch als Rohstoff krebserregend und giftig, da es ein sehr starkes Reduktionsmittel ist.

Aldehyde sind in der Kosmetik nicht wegzudenken,
vor allem als Geruchsstoffe haben sie großen Wert und werden vielfältig eingesetzt.
Reaktionen der Aldehyde
- Nukleophile Addition an der CO-Doppelbindung
- Addition von Wasser an Aldehyde (=Hydratbildung)
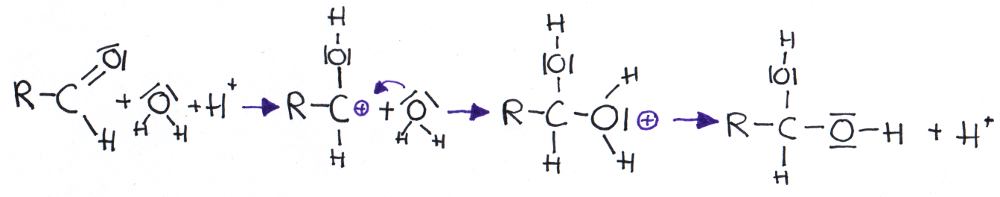
- Addition von Alkoholen an Aldehyde (=Halbacetalbildung)
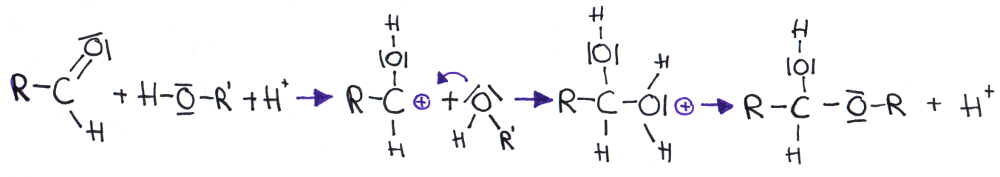
Nachweise von Aldehyden
1. Die Fehlingprobe
Unter anderem können Aldehyde durch die Fehlingprobe nachgewiesen werden. Die Fehlingprobe ist nach ihrem Veröffentlicher Hermann Fehling benannt.
Zum Aufbau des Nachweises werden zwei Fehlinglösungen benötigt.
Fehlinglösung 1 ist eine verdünnte Kupfersulfatlösung (CuSO4) und die Fehlinglösung 2 ist ein alkalisches Kaliumnatriumtartrat.
Beide Lösungen werden zusammen mit einer Aldehydprobe (hier Propanal) in einem Reagenzglas behutsam erhitzt.
Die zuvor blaue Lösung hat einen Farbumschlag zu rotbraun. Das entstandene Kupferoxid ist für diese Färbung verantwortlich und weißt somit das Aldehyd nach. Außerdem ensteht Propansäure, da Aldehyde bei Elektronenabgabe zu Carbonsäuren oxidieren.
Redoxreaktion:
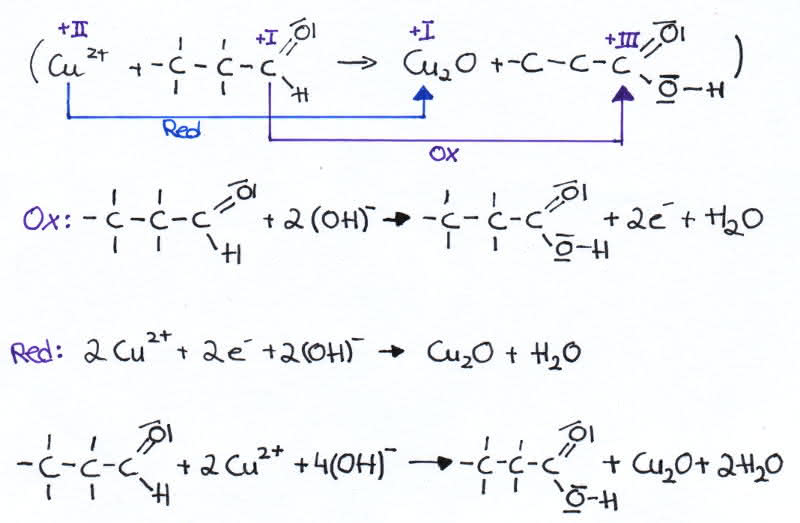
Redoxreaktion der Fehlingprobe (im alkalischen Millieu)
2. Silberspiegelprobe/ Tollensprobe
Eine zweite Methode des Nachweises für Aldehyde ist die Silberspiegelprobe, auch Tollensprobe genannt. Auch dieser Nachweis ist nur für Aldehyde und nicht für Ketone geeignet, genauso wie die Fehlingprobe. Es liegt ebenfalls eine Redoxreaktion vor.
Zum Versuchsaufbau gehört ein sauberes, fettfreies Reagenzglas, einige Tropfen eines Silbernitrats (AgNO3) und Ammoniaksäure (NH3), die zusammen mit einer Aldehydprobe (hier Propanal) auf ungefähr 70°C erhitzt werden. Nach der Erwärmung bildet sich eine silberne, spiegelnde Ablagerung an der Reagenzglaswand. Dafür ist das entstandene Silber verantwortlich, dessen Entstehung das Aldehyd nachweist. Auch hier entsteht Aufgrund der Oxidation des Aldehyds Propansäure.
Redoxreaktion:
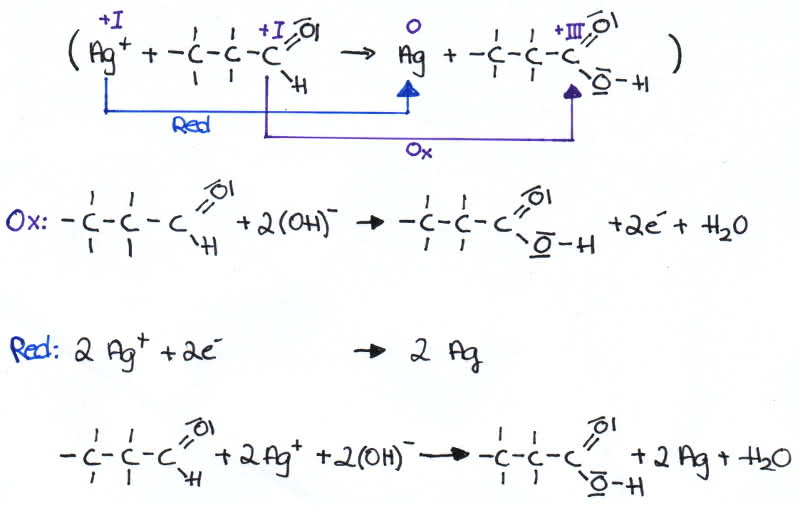
Redoxreaktion der Silberspiegelprobe - Tollensprobe - Redoxreaktion
