Name: Magdalena Schwander, 2015
Voraussetzungen für eine nukleophile Substitution
Kohlenstoff-Atome sind weniger elektronegativ als Halogen-Atome. Aus diesem Grund erfolgt eine ungleiche Ladungsverteilung der C-X-Bindung. Das C-Atom ist positiv und das Halogen-Atom negativ polarisiert.
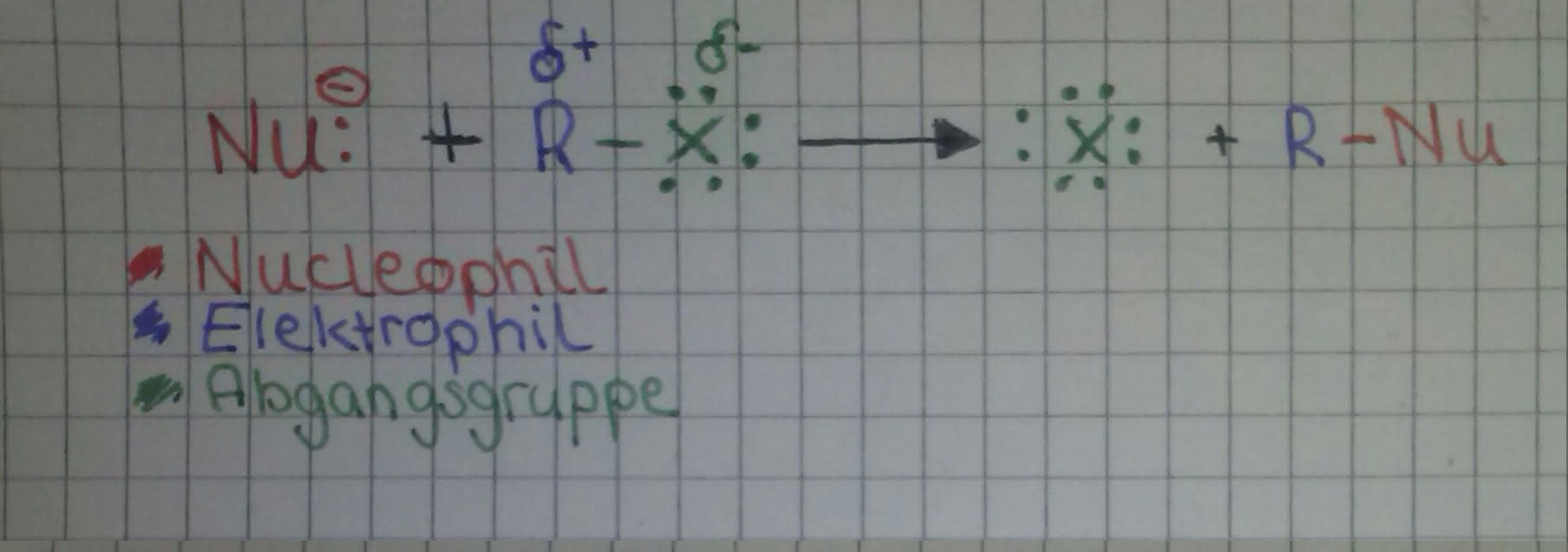
Nun reagiert das Substrat (als Elektrophil ) mit einem Nucleophil, daher wird diese chemische Reaktion als nucleophile Substitution (SN) bezeichnet. Es gibt zwei SN-Mechanismen. Welcher Mechanismus wahrscheinlicher ist wird von vier Faktoren bestimmt:
- Struktur des Substrats
- Reaktivität und Struktur de Nucleophils
- Natur der Abgangsgruppe
- das verwendete Lösungsmittel
Faustregel: Je stabiler das Carbokation ist (durch +I-Effekte), desto eher ist der SN1 Mechanismus gegenüber dem SN2 Mechanismus begünstigt.
=> tertiäre Alkohole reagieren eher nach SN1, primäre eher nach SN2.
SN1
Ohne Einfluss des Nucleophils wird die Kohlenstoff-Ligand-Bindung (Ligand = Lewis-Base = Elektronenpaar-Donator) heterolytisch gespalten. Durch die Abgabe bildet sich ein Carbokation (a), anschließend reagiert es mit dem Nucleophil und bildet das Substitutionsprodukt (b).
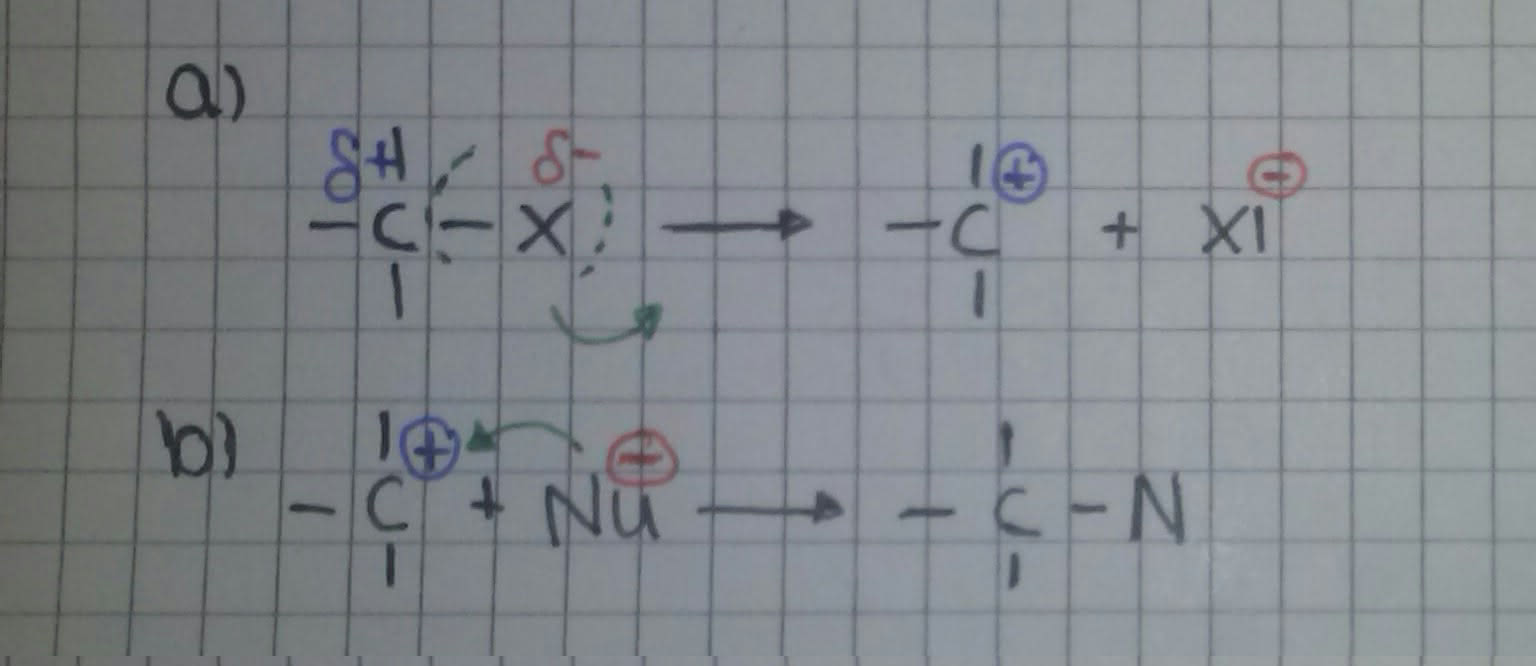
In diesem Mechanismus wird die gesamte Reaktion vom Substrat beeinflusst. Die Reaktionsgeschwindigkeit ist daher lediglich von der Konzentration des Halogenalkans abhängig => monomolekulare nucleophile Substitution: SN1 .
SN2
Das positiv polarisierte Kohlenstoff-Atom wird von einem Nucleophil angegriffen. Dieser Angriff bewirkt eine heterolytische Spaltung der Kohlenstoff-Ligand-Bindung, bei der der Ligand (X) das Bindungselektronenpaar erhält. Bei dieser Reaktion läuft die Abspaltung und der rückseitige Angriff gleichzeitig ab. Das heißt, dass in der Geschwindigkeit in der das Nucleophil sich bindet, spaltet sich der Ligand.
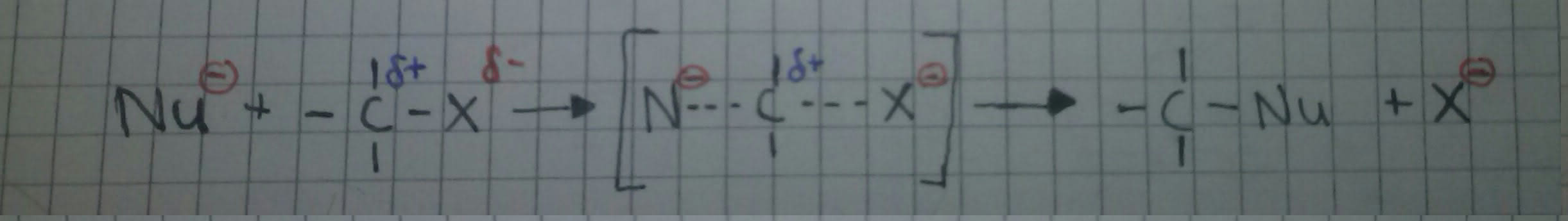
Die Reaktionsgeschwindigkeit ist also sowie von der Konzentration des Nucleophils, als auch von der Konzentration des Substrats abhängig =>bimolekulare nucleophile Substitution: SN2.
Reaktion vom Substrat beeinflusst. Die Reaktionsgeschwindigkeit ist daher lediglich von der Konzentration des Halogenalkans abhängig => monomolekulare nucleophile Substitution: SN1.
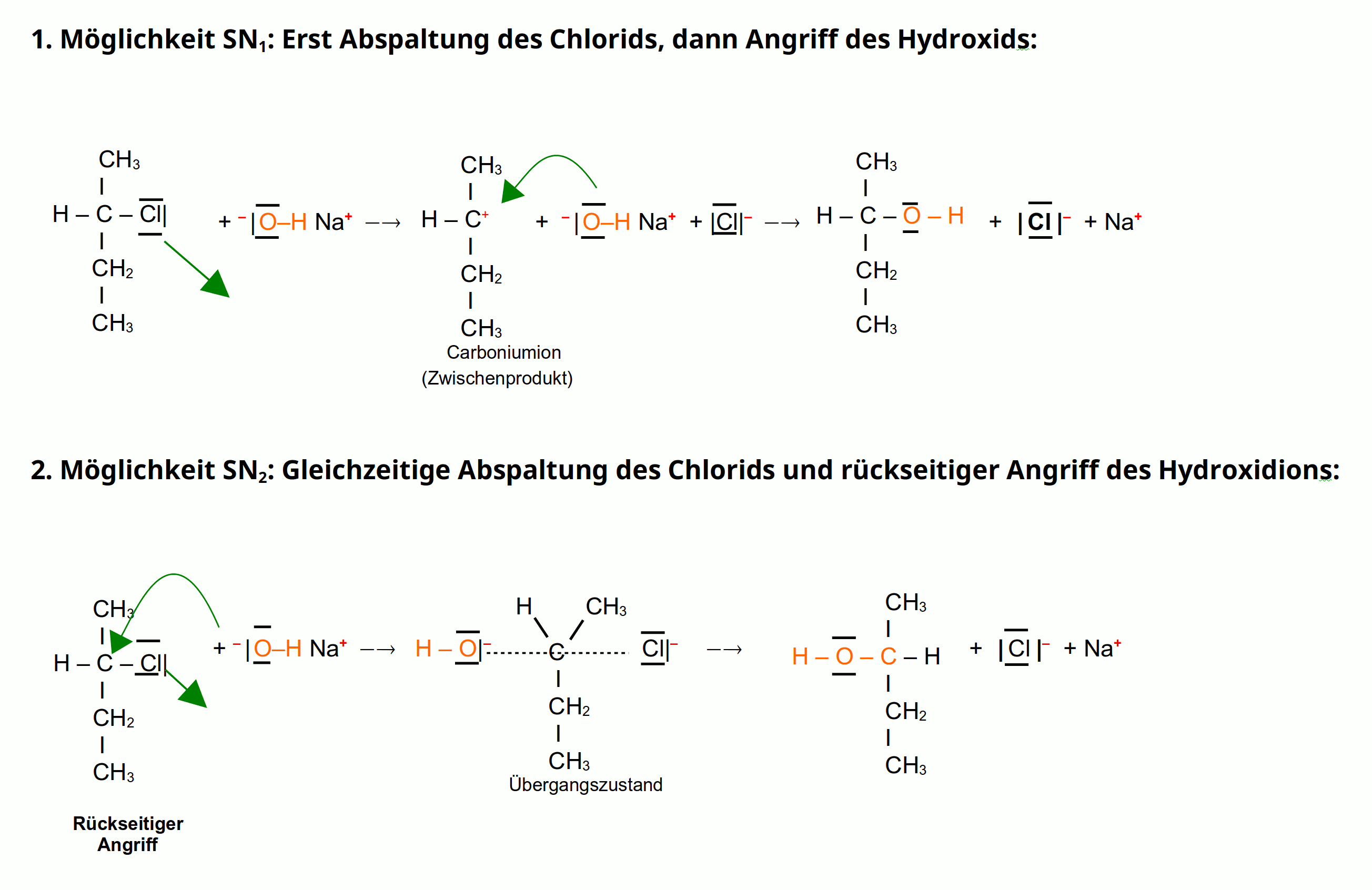
Nukeleophile Substitution im Vergleich: SN1 & SN2
(Klicken zum Vergrößern)
Das positiv polarisierte Kohlenstoff-Atom wird von einem Nucleophil angegriffen. Dieser Angriff bewirkt eine heterolytische Spaltung der Kohlenstoff-Ligand-Bindung, bei der der Ligand (X) das Bindungselektronenpaar erhält. Bei dieser Reaktion läuft die Abspaltung und der rückseitige Angriff gleichzeitig ab. Das heißt, dass in der Geschwindigkeit in der das Nucleophil sich bindet, spaltet sich der Ligand.
Die Reaktionsgeschwindigkeit ist also sowie von der Konzentration des Nucleophils, als auch von der Konzentration des Substrats abhängig =>bimolekulare nucleophile Substitution: SN2.
Bei dieser nukleophilen Substitution (SN2) können Stereoisomere entstehen.
Energiediagramm SN1 & SN2
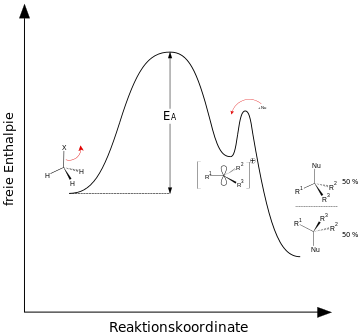
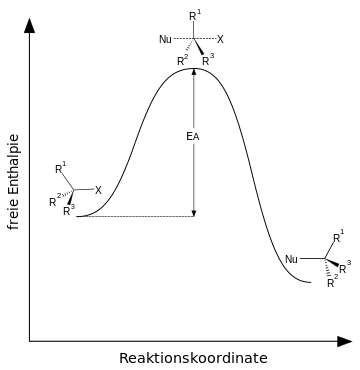
Quelle Bilder: CC BY-SA 3.0 von Wikipediaauthor Minihaa: http://de.wikipedia.org/wiki/Nukleophile_Substitution#mediaviewer/File:Reaktionskoordinate_der_SN1-Reaktion.svg
