Name: Hopemaster, 2021-03
Die Veresterung ist ein komplexer Mechanismus, der schrittweise zur Bildung von Ester und Wasser aus Alkohol und Carbonsäure führt. Dabei muss nicht zwangsweise eine organische Säure vorliegen.
Bildung von Essigsäure-n-butylester
Am Beispiel der Bildung von Essigsäure-n-butylester (Butylethanoat), einem Bestandteil des Apfelaromas soll die Veresterung gezeigt werden. In fünf Schritten findet dabei die Reaktion statt:
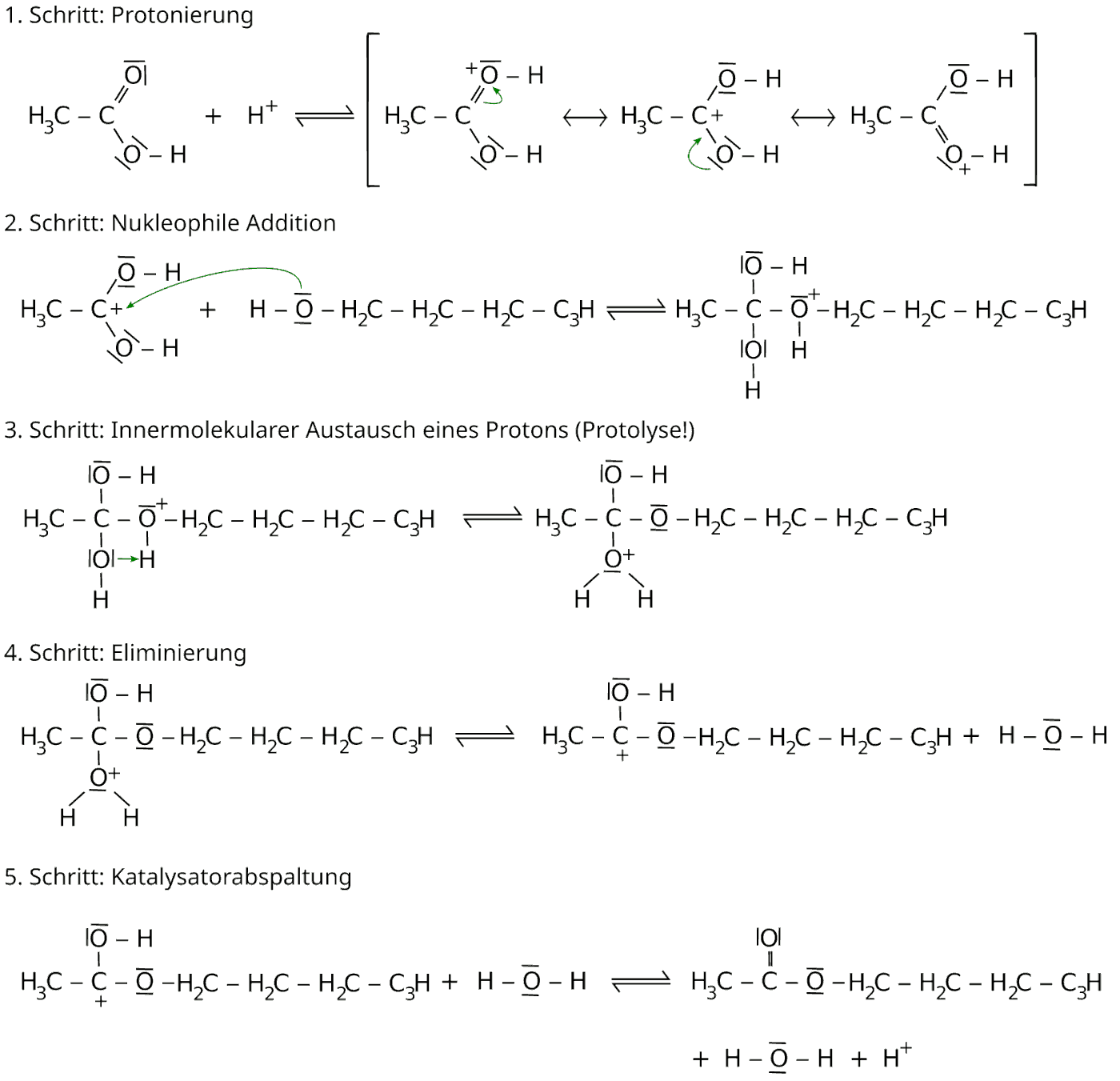
Erklärung der Veresterung:
1. Schritt: Protonierung
Durch Zugabe von Säure (z.B. Schwefelsäure) werden Protonen freigesetzt, welche die Carboxylgruppe angreifen. Es entstehen positive Sauerstoffionen (= Oxoniumionen), welche in drei mesomeren Grenzstrukturen vorliegen. Das Ion ist mesomeriestabilisiert.
Dabei gilt: Je mehr mesomere Grenzstrukturen vorliegen, desto stabiler ist ein Zwischenprodukt.
2. Schritt: Nukleophile Addition
Nukleophiler Angriff durch das freie alkoholische Elektronenpaar des negativ polarisierten Sauerstoffatoms am positiven Sauerstoffatom der protonierten Carbonsäure.
3. Schritt: Innermolekularer Austausch eines Protons
Abspaltung des Proton vom positiven Sauerstoff und Bindung am benachbarten Sauerstoff.
4. Schritt: Eliminierung
Abspaltung von Wasser. Das Zwischenprodukt enthält nun ein Carbeniumion.
5. Schritt: Katalysatorabspaltung
Abspaltung des Protons von der Hydroxidgruppe wird der Katalysator wieder freigesetzt. Das zurückbleibende Elektronenpaar „klappt“ ein und so entsteht eine Doppelbindung zum Sauerstoff.
Mehr Informationen zur Veresterung in Kapitel 10 "Ester": https://hoffmeister.it/index.php/chemiebuch-organik
