Name: Rhoda Werner, 2021-06
Titration von Glycin
Bei einer Titration handelt es sich um ein Analyseverfahren, mit welchem man zum einen die Konzentration einer Lösung und zum anderen, wie in diesem Fall, den Bereich des isoelektrischen Punktes bestimmen kann.
Die kleinste und einfachste α-Aminosäure mit der Formel C2H5NO2 nennt man Glycin.
Versuch:
Benötigte Chemikalien:
- 20 ml Salzsäure (HCl) mit der Konzentration c = 0,1 mol/l
- 50 ml Natronlauge (NaOH) mit der Konzentration c = 0,1 mol/l
Benötigte Materialien:
- eine Wage
- zwei Messzylinder
- ein Messbecher
- ein Trichter
- eine Bürette + Halterung
- ein Magnetrührer mit „Rührschweinchen“
- ein pH-Messgerät
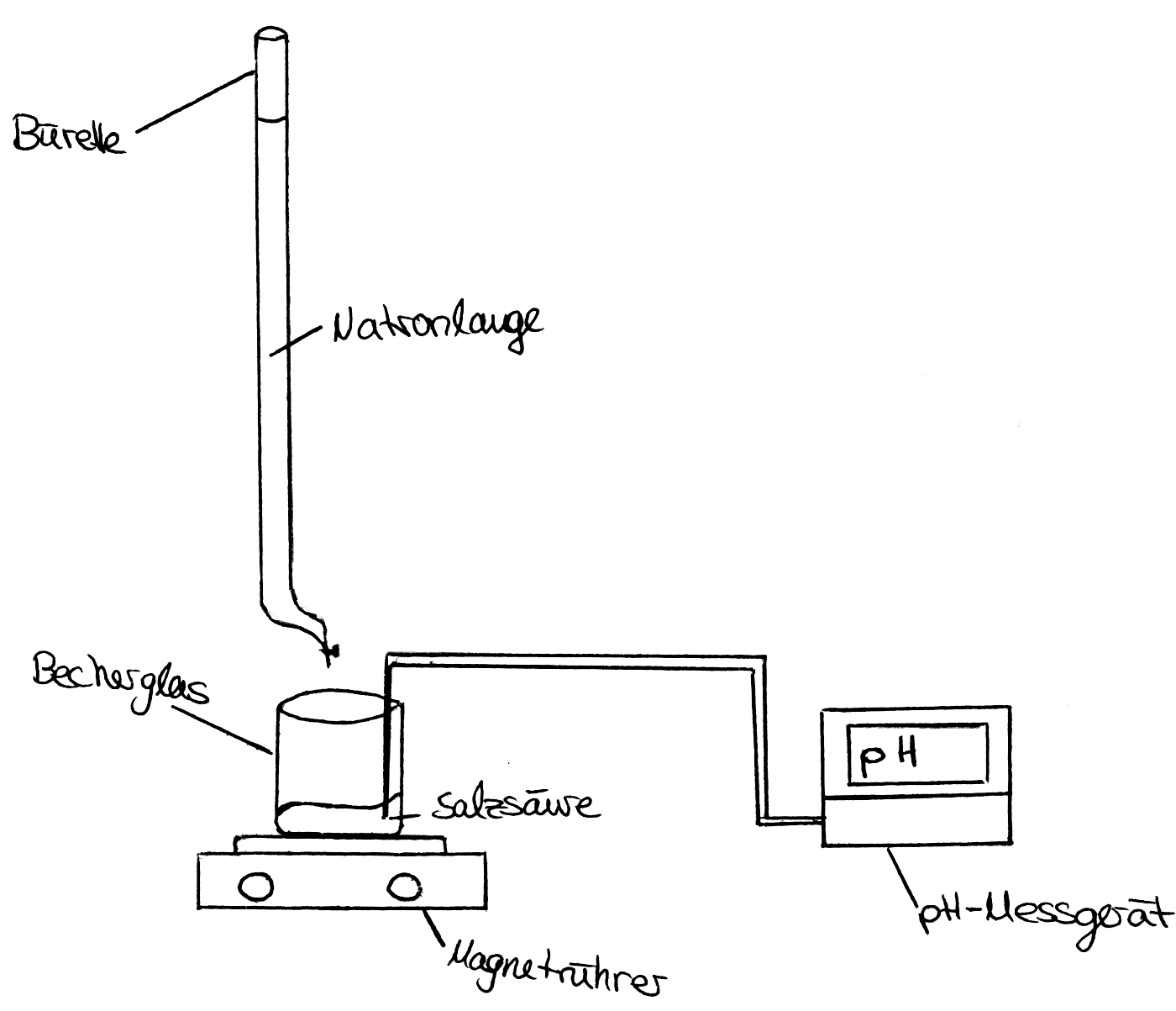
Versuchsaufbau der Glycintitration (mit Bürette)
Versuchsanleitung:
1. Schritt: Messen Sie die benötigten Lösungen mit einem Messzylinder ab und stellen Sie dabei, falls noch nicht geschehen, die richtige Konzentration her.
2. Schritt: Füllen Sie die Salzsäure in ein Becherglas und die Natronlauge durch den Trichter in die schon an der Halterung befestigte Bürette.
3. Schritt: Stellen Sie das Becherglas mit der Salzsäure auf den Magnetrührer und legen Sie das „Rührschweinchen“ hinein. Stellen Sie nun den Magnetrührer unter die Bürette, schalten Sie ihn ein und legen Sie die Glaselektrode des pH-Messgeräts in die Lösung.
4. Schritt: Beginnen Sie die Titration und messen Sie zunächst nach jedem Milliliter den pH-Wert, bis Sie ca. 4 ml hineingegeben haben. Nun machen Sie in Schritten von 0,5 ml weiter. Ab ungefähr 11 ml können Sie die Geschwindigkeit wieder erhöhen, bis Sie die Salzsäure mit der gesamten Natronlauge titriert haben.
5. Schritt: Säubern Sie alle verwendeten Materialien und entsorgen Sie die Chemikalien ordnungsgemäß.
Versuchsergebnisse:
| Volumen (ml) | pH-Wert |
| 0 | 1,87 |
| 2,1 | 2,00 |
| 3,0 | 2,07 |
| 4,5 | 2,18 |
| 5,0 | 2,22 |
| 5,7 | 2,27 |
| 6,0 | 2,31 |
| 6,7 | 2,37 |
| 7,0 | 2,40 |
| 7,5 | 2,44 |
| 8,0 | 2,48 |
| 8,5 | 2,53 |
| 9,0 | 2,57 |
| 9,5 | 2,61 |
| 10,0 | 2,66 |
| 10,5 | 2,71 |
| 11,0 | 2,76 |
| 12,0 | 2,87 |
| 13,0 | 2,99 |
| 14,0 | 3,14 |
| 15,0 | 3,34 |
| 16,0 | 3,68 |
| 17,0 | 7,08 |
| 18,0 | 8,38 |
| 19,1 | 8,74 |
| 20,0 | 8,89 |
| 22,0 | 9,17 |
| 24,0 | 9,38 |
| 26,0 | 9,54 |
| 29,0 | 9,79 |
| 32,0 | 10,06 |
| 35,0 | 10,42 |
| 40,0 | 11,42 |
| 45,1 | 11,81 |
| 50,0 | 11,98 |
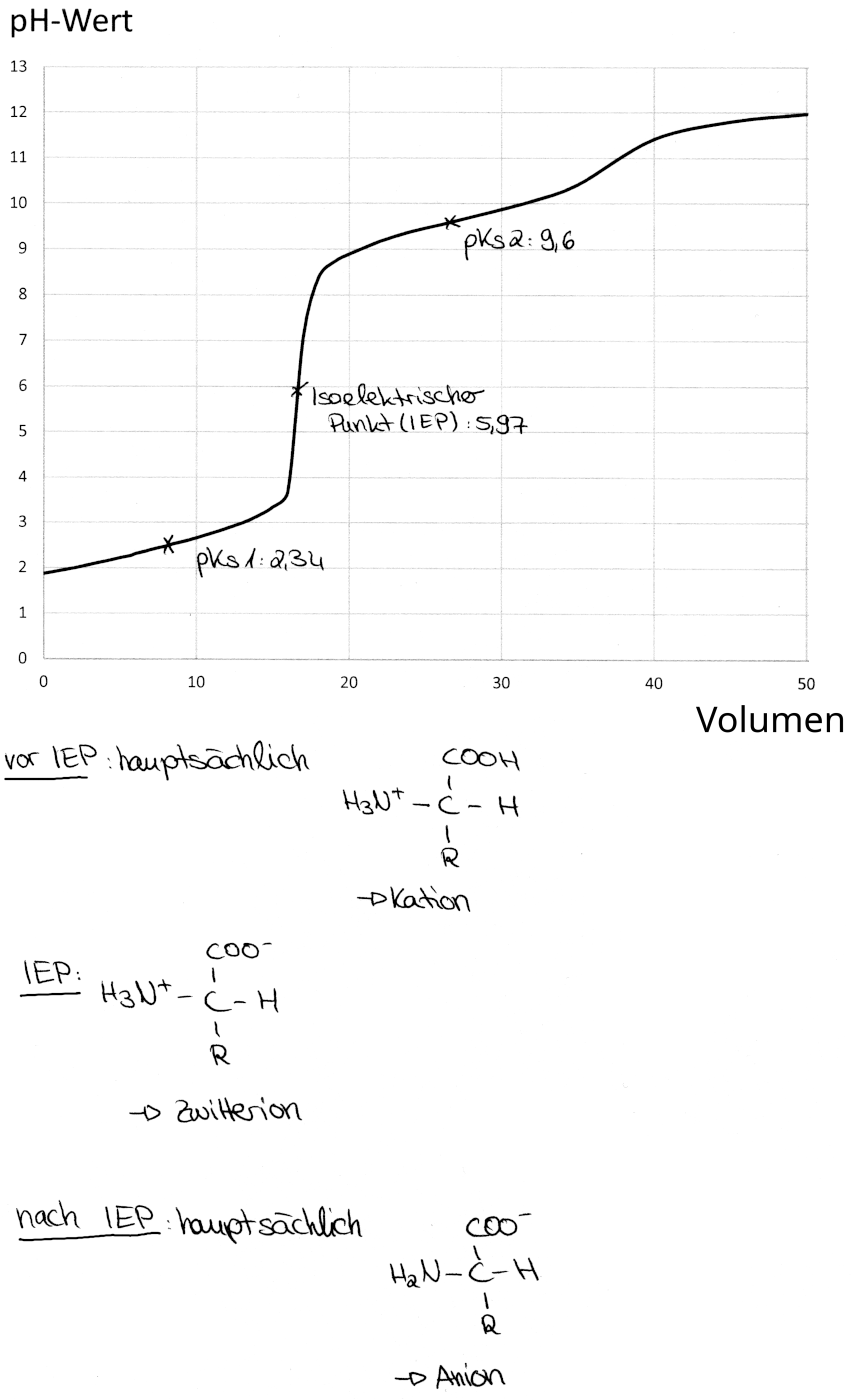
Diagramm der Glycintitration (Diagramm mit den wichtigsten Ionen)
Beobachtung:
- Zunächst erhöht sich der pH-Wert beim hereingeben der Natronlauge nur sehr langsam.
- Nachdem ca. 3,5 ml titriert wurden, steigt der pH-Wert viel stärker an.
- Ab ungefähr 8,8 ml verlangsamt sich die Erhöhung des pH-Werts wieder.
Erklärung:
Die langsame Änderung des pH-Werts ist darauf zurückzuführen, dass die zugegebenen Hydroxidionen zu Beginn auf sehr viele freie Protonen kommen. Diese sorgen für ein stark saures Milieu und fangen die Hydroxidionen sozusagen ab. Je weiter die Titration jedoch fortgeschritten ist, desto mehr Hydroxidionen reagieren auch mit den Protonen, deren Zahl zunehmend abnimmt. Dadurch ändert sich der pH-Wert nun sehr viel schneller. An einem gewissen Punkt sind alle Protonen neutralisiert, sodass die weitere Zugabe von Hydroxid die Lösung in den alkalischen Bereich bringt. Irgendwann flacht die Kurve des pH-Werts wieder ab, weil die hinzukommenden Hydroxidionen bei der schon hohen Konzentration von diesen kaum eine Änderung des pH-Werts stattfinden lassen.
Bei dieser Lösung liegt der isoelektrische Punkt (IEP) bei einem pH-Wert von 5,97. An diesem Punkt liegen ausschließlich Zwitterionen, welche sowohl positive als auch negative Ladungen tragen, also gleichzeitig Säure und Base sind, vor:
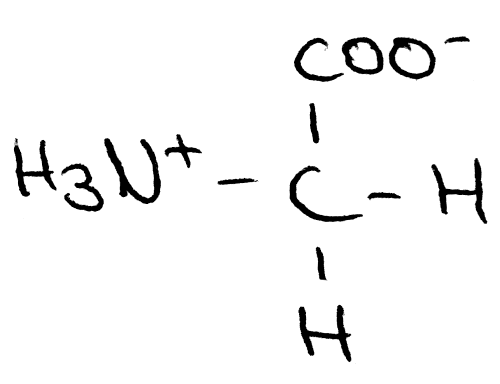
Glycin als Zwitterion
Der IEP gibt also einen pH-Wert an, an dem die positiven und negativen Ionen einer Aminosäure, hier Glycin, der von Wasser gleichen.
Schlussfolgerung: Glycin ist ein Ampholyt (= kann sowohl Säure als auch Base sein).
