Name: Joschua, 2021-06
Anorganische Ester
Ester bilden in der Chemie eine Stoffgruppe chemischer Verbindungen, die durch die Reaktion einer Säure und eines Alkohols unter Abspaltung von Wasser entstehen. Es gibt Ester von organischen Säuren (z.B. Carbonsäuren wie Essigsäure, Ameisensäure) und von anorganischen Säuren (z.B. Phosphorsäure, Schwefelsäure, Kohlensäure).
Im Grunde genommen unterscheiden sich die anorganischen Ester von den organischen Estern kaum.
Organische Ester haben die funktionelle Gruppe R1-COOR2 (R1=Rest 1, R2=Rest 2)
Anorganische Ester besitzen die funktionelle Gruppe R1-XOOR2 (R1=Rest 1, R2=Rest 2, X=zentrales Nichtmetallatom der Säure, z.B. S (Schwefel), P (Phosphor).
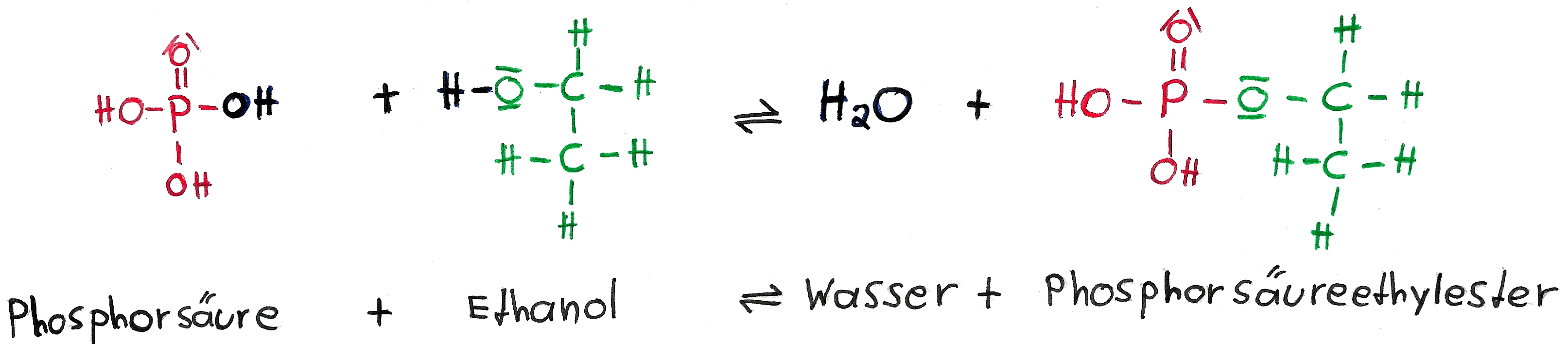
Phosphorsäureester
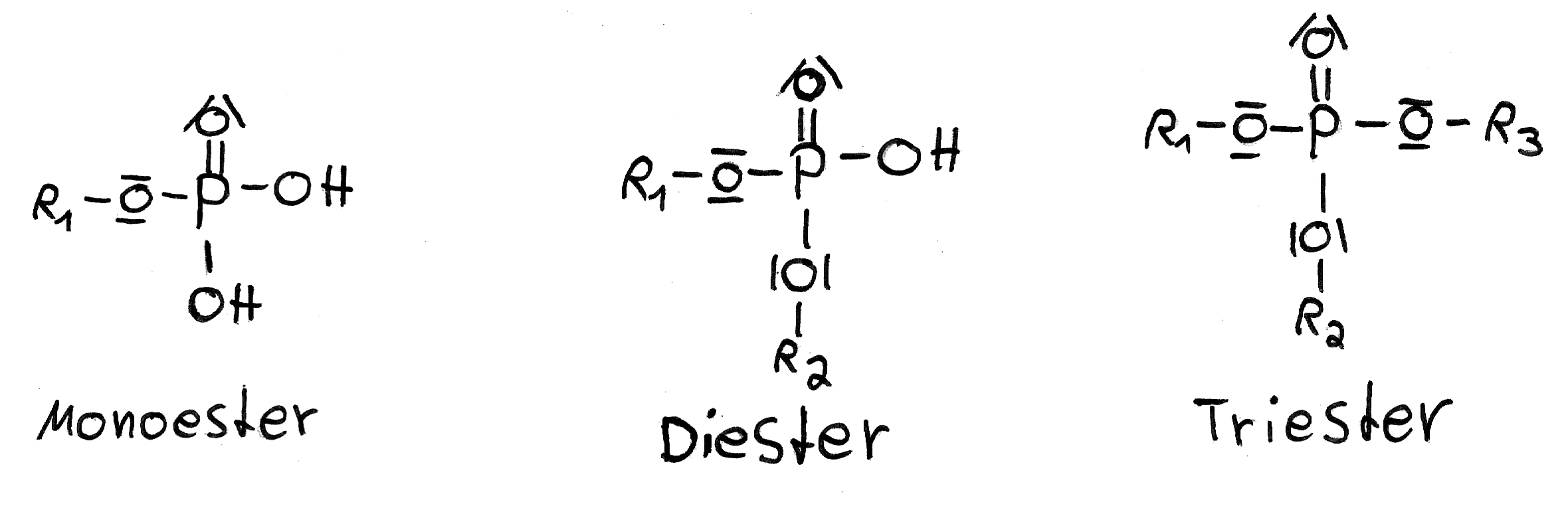
Phosphorsäure verfügt über drei Hydroxidgruppen und kann somit gut Phosphorsäureester bilden. Diese Ester bilden sich auch unter Abspaltung von Wasser.
- leicht hydrolysierbar (durch Wasser spaltbar) und auch leicht enzymatisch und abiotisch abbaubar.
- teilweise sehr gut fettlöslich (lipophil).
- hohe Toxizität und damit verbunden geringe Aufwandmenge.
- große Variabilität der Verbindungen, d.h., es sind viele verschiedene Verbindungen möglich, so dass die Entstehung von Resistenzen vermindert wird.
Phosphorsäureester dienen in Kunststoffen und Lacken als Weichmacher, Flammschutzmittel, Härter, als Beiz- und Haftmittel beim Aufbringen von Farben und Lacken, in der Metalloberflächenbehandlung als reinigende, korrosionshemmende und haftvermittelnde Substanzen, als Hilfsmittel für Textilien und Papier, als Putz- und Reinigungsmittel, Hydraulik-Flüssigkeit (Skydrol), Öl- und Treibstoffadditive. Industriell hergestellte Phosphorsäureester sind u.a. als starke Insektengifte bekannt. Dazu gehört das bekannte E605 (Parathion). Als Nervengift wurden Phosphorsäureester auch in hochtoxischen chemischen Kampfstoffen verwendet. Bekannte Vertreter sind Sarin, Tabun und Soman.
In der Natur findet man Phosphorsäureester zum Beispiel in der DNA, denn Nukleinsäuren sind verknüpfte Ketten, welche abwechselnd Phosphorsäure mit der Alkoholfunktion von Zuckern (z.B. Ribose oder Desoxyribose) in Esterbindungen verknüpft haben.
Schwefelsäureester (Sulfate)
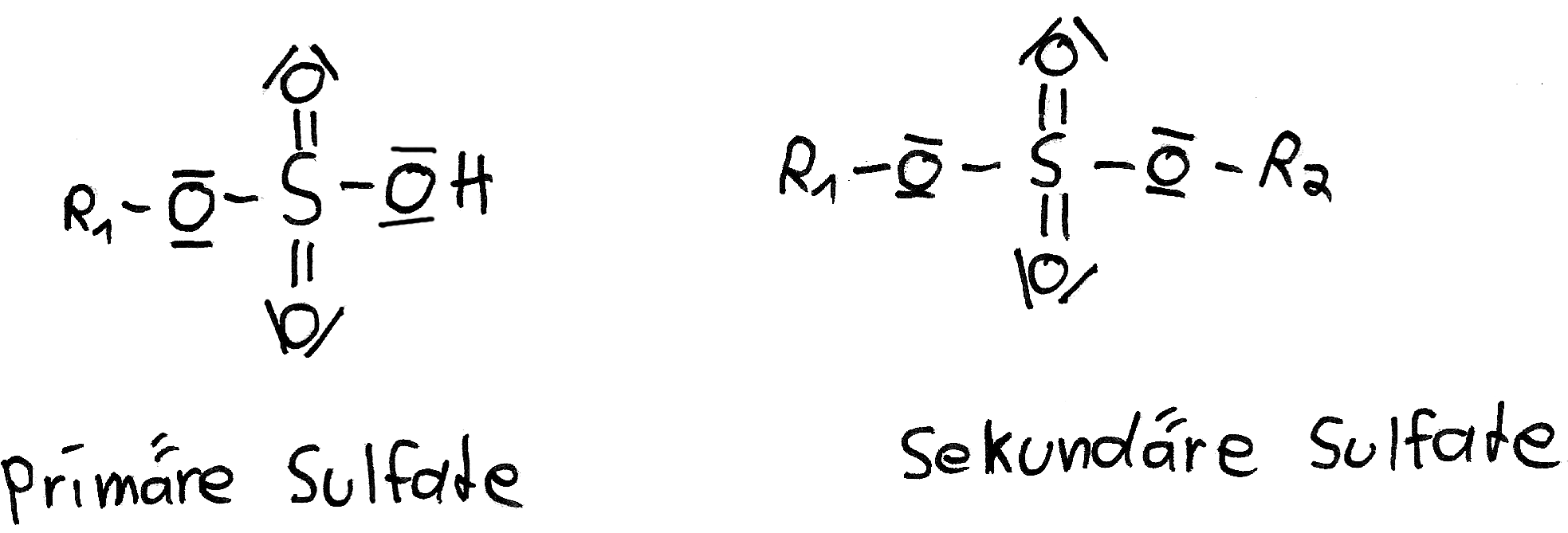
Auch Schwefelsäure bildet Ester aus. Diese Schwefelsäureester findet man in der lebendigen Natur sehr häufig. Carrageen zum Beispiel ist Bestandteil der Gehirnsubstanz. Weiterhin findet man sie in Tensiden (Alkylsulfate) und in kosmetischen Produkten. Dimethylsulfat und Diethylsulfat werden in der chemischen Industrie als Ausgangsstoffe für Synthesen verwendet und sind kräftige Alkylierungsmittel.
Schwefelsäureester werden gelegentlich auch als Sulfate bezeichnet, da die Namen häufig auf -sulfat enden.
Die meisten Sulfate sind in Wasser löslich. Ausnahmen bilden die wenig oder schwerlöslichen Sulfate der Erdalkalimetalle Calciumsulfat, Strontiumsulfat, Bariumsulfat und Radiumsulfat sowie Blei(II)-sulfat. Das Radiumsulfat ist dabei das schwerlöslichste Sulfat, das man kennt. Besonders die Alkali- und Erdalkalisulfate sind thermisch äußerst stabil. Sulfate dreiwertiger Metallkationen zersetzen sich in der Wärme zu den entsprechenden Oxiden und Schwefeltrioxid.
Viele Metallsulfate kommen in der Natur in Form von Mineralen vor. Das mit Abstand häufigste ist Calciumsulfat (CaSO4), das in mehreren Mineralvarietäten auftritt. Mit Kristallwasseranteil wird es als Gips (CaSO4 · 2 H2O) oder Bassanit (CaSO4 · ½ H2O) bezeichnet, ohne als Anhydrit. Die reinweiße und extrem feinkörnige Gipsvariante wird Alabaster genannt, transparente Gips-Einkristalle bilden das Marienglas. Die bedeutendsten Gips- bzw. Anhydritvorkommen in Mitteleuropa befinden sich in der sogenannten Zechsteinserie, meist tief im Untergrund Nord- und Mitteldeutschlands sowie Polens. An den Rändern der variszischen Gebirgsrümpfe reichen die Zechstein-Anhydrite teilweise bis an die Erdoberfläche und werden dort in Steinbrüchen abgebaut. Ein weltberühmtes Gipsvorkommen befindet sich in Mexiko in den durch die Mine von Naica erschlossenen Höhlen. Weitere wichtige Sulfatminerale sind Baryt (Schwerspat, BaSO4), Coelestin (SrSO4) und Anglesit (PbSO4).
Eine biologische Quelle für Sulfate ist die Umwandlung von Sulfiden und schwefelhaltigen Biomasse-Bestandteilen (z. B. Proteinen) durch schwefeloxidierende Bakterien.
Sulfate kommen in unterschiedlichen Mengen im Grundwasser vor. Für daraus gewonnenes Trinkwasser gilt in Deutschland nach Nr. 17 der Anlage 3 (zu § 7 und § 14 Absatz 3) der Trinkwasserverordnung ein Grenzwert von 250 mg/l.
