Name: Sophie Meffert, 2018-04
pH-Wert-Bestimmung mit der pH-Elektrode
Die pH-Elektrode dient der Messung des pH-Wertes, wobei in der Praxis meist mit einer Glaselektrode gearbeitet wird. Eingesetzt wird sie bei der pH-Wert-Messung im Labor, bei der Durchführung von Säure-Base-Titrationen, wie auch bei der pH-Wert-Bestimmung in Aquarien.
Vor der Messung muss die pH-Elektrode kalibriert werden. Dazu wird die Elektrode in mehrere Pufferlösungen (oft pH7 und 11) mit definiertem pH-Wert getaucht und so auf einen bestimmten pH-Wert, den Sollwert, geeicht. Dabei muss angesichts der Temperaturabhängigkeit des pH-Wertes auf die Temperatur des Puffers geachtet werden.
Die Messung erfolgt durch das Eintauchen der Elektrode in die zu untersuchende Lösung, wobei die Temperatur beim ermittelten Messwert anzugeben ist. Weiterhin ist oft eine gewisse Zeit zur Stabilisierung des Messwertes zu erwarten.
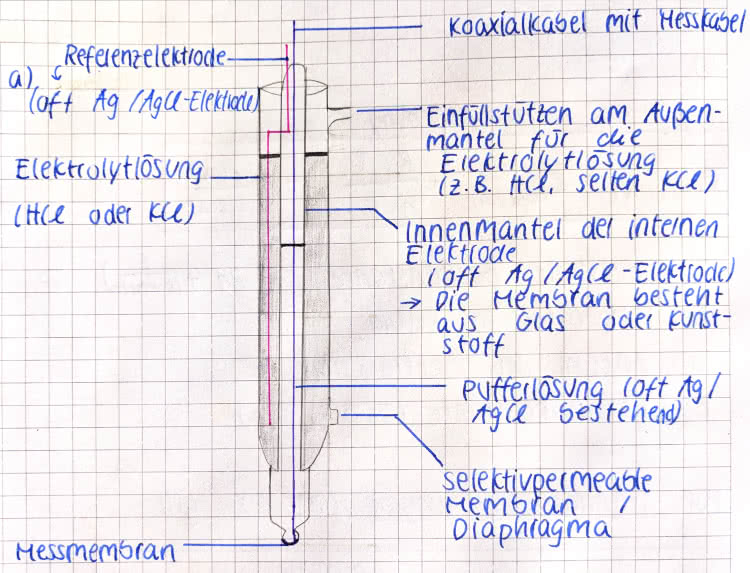
Zum Aufbau der pH-Elektrode:
- Koaxialkabel mit dem Messkabel
- Referenzelektrode
- Einfüllstutzen am Außenmantel für die Elektrolytlösung
- Elektrolytlösung
- Innenmantel der internen Elektrode
- Pufferlösung àpH-Wert ändert sich bei Säure-/Basenzugabe nicht
- Selektivpermeable Membran/Diaphragma àschafft Verbindung zwischen Elektrolyt und Messlösung
- Messmembran
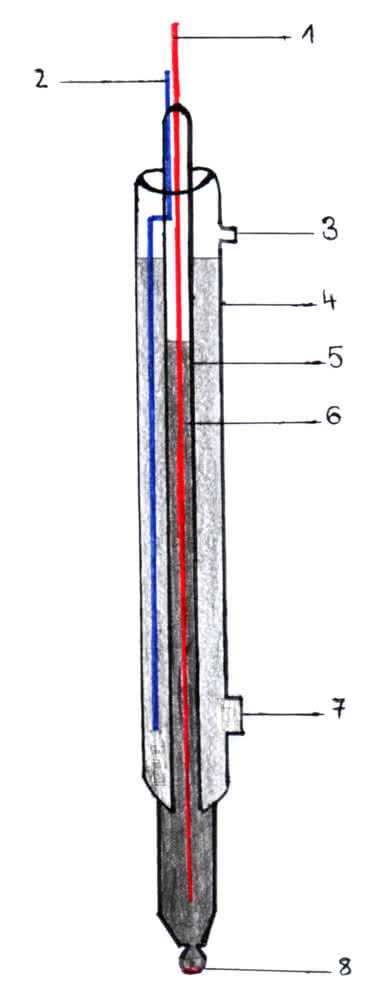
Zur pH-Messung sind zwei Elektroden notwendig: Neben der Glaselektrode selbst wird eine Bezugselektrode benötigt. Meistens werden beide in einer sogenannten Einstabmesskette vereint: Sie besteht aus einem inneren Rohr und einem äußeren Mantel, wobei letzterer als Referenzelektrode dient und aus einem Silberdraht, Silberchlorid und einer Elektrolytlösung (meist Kaliumchlorid) aufgebaut ist. Ebenso befinden sich im inneren Rohr Silberdraht, Silberchlorid und eine Kaliumchloridlösung, die zusätzlich noch einen Puffer enthält. Das innere Rohr ist mit der Glasmembran und somit mit der zu messenden Lösung verbunden, der äußere Mantel wiederum mit einem Diaphragma.
Die Elektrode darf niemals längere Zeit trocken oder in destilliertem Wasser gelagert werden, damit die untere Messmembran nicht austrocknet und somit unwirksam wird.
Messen und berechnen des Elektrodenpotentials einer Wasserstoffhalbzelle
Das betreffende galvanische Element ist also das H3O+ /H2 bzw. H+ /H2 - Element. Es gilt die allgemeine Nernstgleichung als Basis:
0,059 V [Ox]
ΔE(H+/H2) = E0(H+/H2) + ———— · lg ————
n [Red]
n = 2, da zwei Elektronen übertragen werden
Die H+-Ionenkonzentration ist nach dem MWG demzufolge: [H+]2
Die reduzierte Form des Elements Wasserstoff, wird wie üblich gleich 1 gesetzt:
ΔE0 (H+/H2) ist das Standardpotential und ist mit 0 definiert.
0,059 V [H+]2
<=> ΔE(H+/H2) = 0 + ———— · lg ————
2 1
0,059 V [H+]
<=> ΔE(H+/H2) = 0 + ———— · 2 lg ———
2 1
<=> ΔE(H+/H2) = 0,059 V · lg [H+]
Der letzte Abschnitt lg [H+] entspricht ja schon bis auf das Vorzeichen dem pH-Wert: lg [H+] = -pH
=> ΔE(H+/H2) = 0,059 V · (- pH)
bzw: ΔE(H+/H2) = - 0,059 V · pH
Messung des pH-Werts mit einer Bezugselektrode
mithilfe der oben genannten pH-Elektrode wird der pH-Wert nun gegen eine zweite Wasserstoffhalbzelle gemessen:
EMK = E(Kathode) - E(Anode) = 0V - (- 0,059 V · pH) = 0,059 V · pH
EMK
<=> pH = —————
0,059 V
pH-Elektrode (Klicken zum Vergrößern)