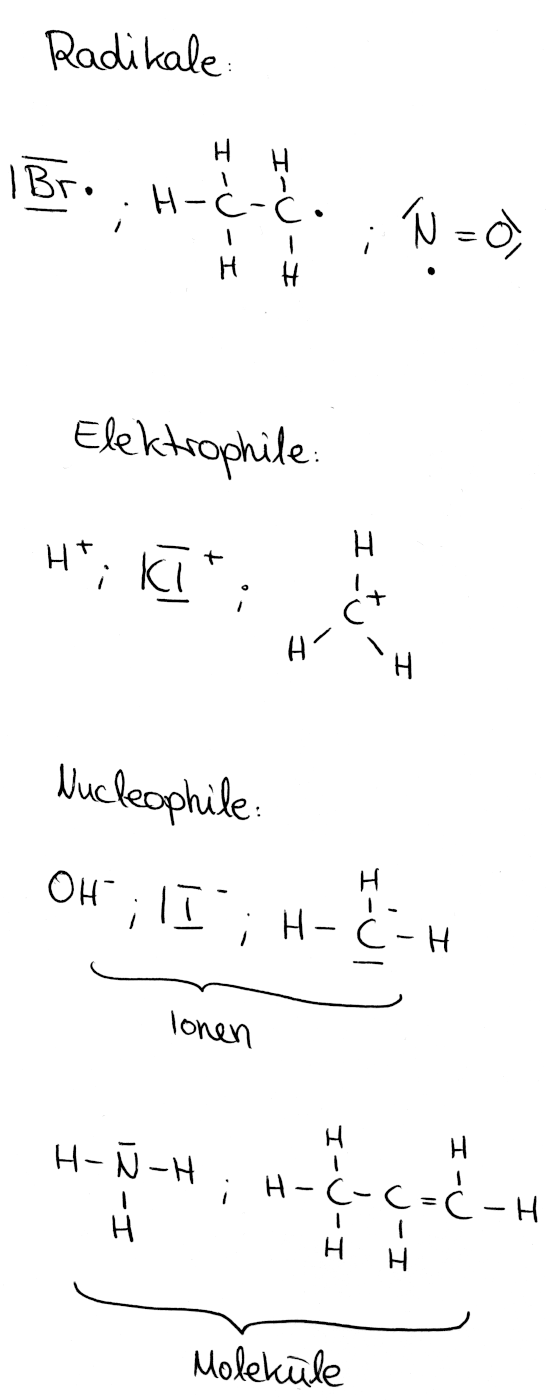Name: Rhoda Werner, 2021-06
Reaktionsmechanismen
Definition „Reaktionsmechanismus“:
Bei organischen Verbindungen läuft eine Reaktion meist in mehreren Teilschritten ab. Diese stellt der sogenannte „Reaktionsmechanismus“ auf Teilchenebene dar, um die Reaktion verständlicher zu machen und Veränderungen einzelner Teilchen/Stoffe während der Reaktion aufzuzeigen. Dabei werden auch auftretende Übergangszustände und Zwischenprodukte abgebildet.
Reaktionstypen:
Aufteilung der verschiedenen Arten von Reaktionen, die sich nach den Änderungen bei den jeweils reagierenden Teilchen richtet.
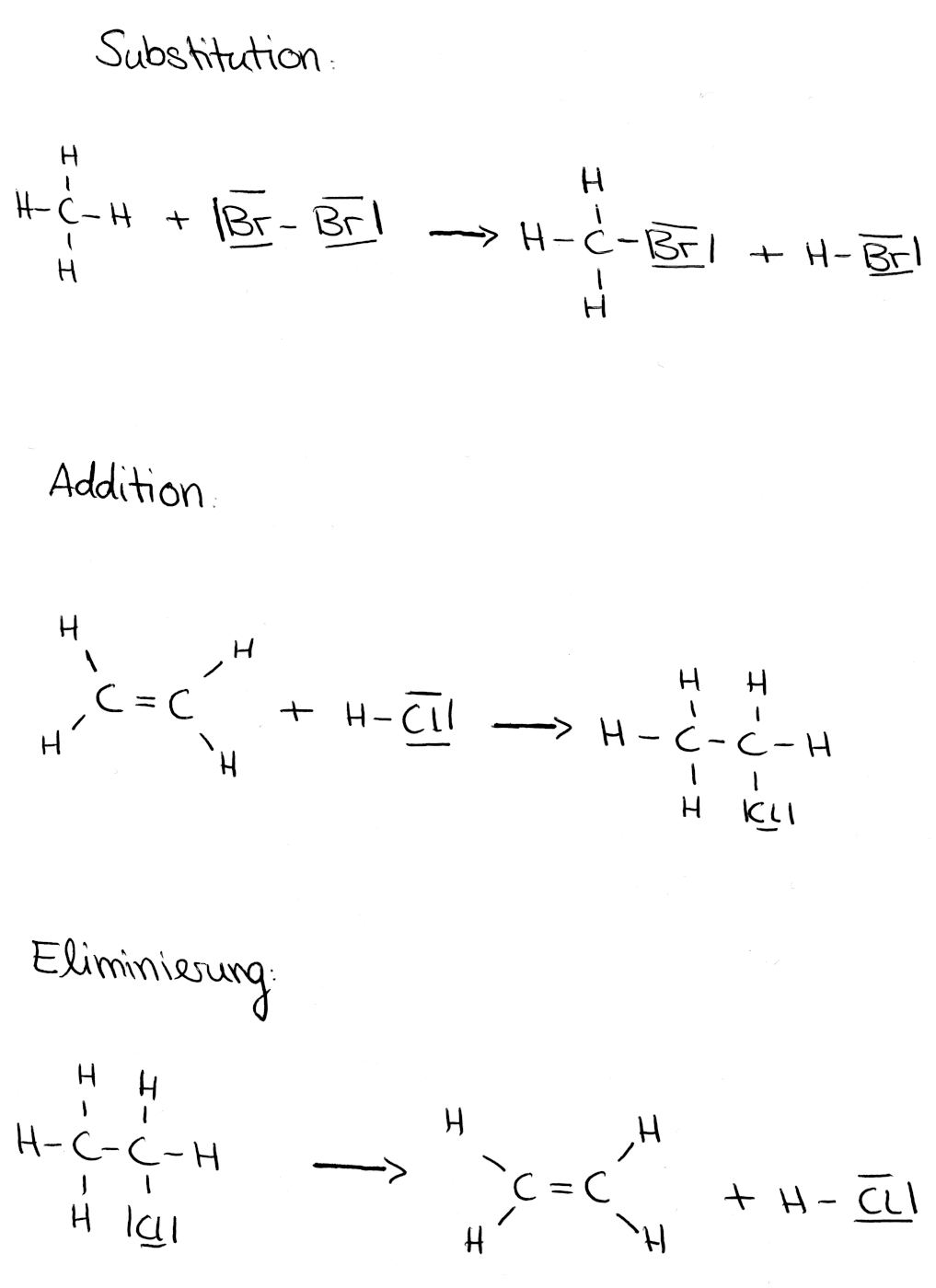
1) Substitution:
Bei einer Substitution (Latein: ‘substituere‘= ersetzen) findet ein Ersetzen der an eine Kohlenstoffkette gebundenen Atome oder gar funktionellen Gruppen, welche im Ausgangsstoff enthalten sind, durch andere Stoffe (Atome oder Atomgruppen) statt. Diese Art der Reaktion ist charakteristisch für Alkane (Kohlenstoffverbindung mit vier Einfachbindungen) oder anderen gesättigte Verbindungen.
2) Addition:
Bei einer Addition (Latein: ‚addere‘ = hinzufügen) können durch die Auftrennung einer Mehrfachbindung (Doppelbindung/ Dreifachbindung) andere Atome oder Moleküle an diese gebunden werden. Dabei bleiben die Bindungselektronen zum Teil, z.B. als Einfachbindung, vorhanden, während die Übrigen den neuen Stoff an das Molekül binden. Somit werden mehrere Atome bzw. Moleküle zu einem einzigen Molekül zusammengefügt, was zur Sättigung der Kohlenstoffkette führen kann. Diese Reaktionsart findet sich daher bei ungesättigten Verbindungen, wie Alkanen und Alkinen. (Umkehrreaktion der Eliminierung)
3) Eliminierung:
Bei einer Eliminierung (Latein: ‚eliminare‘ = entfernen) wird durch die Entfernung der an eine Kohlenstoffkette gebundenen Atome oder Moleküle mit einer Elektronenpaarbindung, welche bei dieser Bindung beteiligt war, eine Mehrfachbindung gebildet. Dieser Reaktionstyp sorgt dafür, dass eine zunächst gesättigte Kohlenstoffkette zu einer ungesättigten wird. (Umkehrreaktion der Addition)
Reaktionsmechanismen der organischen Chemie I
Spaltungsarten:
Homolytische Spaltung:
Gleichmäßige Aufteilung der an einer kovalenten Bindung beteiligten Bindungselektronen auf beide Bindungspartner
Heterolytische Spaltung:
Die bei einer kovalenten Bindung beteiligten Bindungselektronen werden dem elektronegativeren Bindungspartner zugeteilt
Reaktive Teilchen:
Teilchen, die für das Stattfinden einer Reaktion einen „Angriff“ an Reaktionspartnern durchführen.
1) Radikale:
Radikale sind Atome oder Moleküle, die, bedingt durch eine homolytischen Spaltung, geringstenfalls ein ungepaartes (Valenz-) Elektron besitzen.
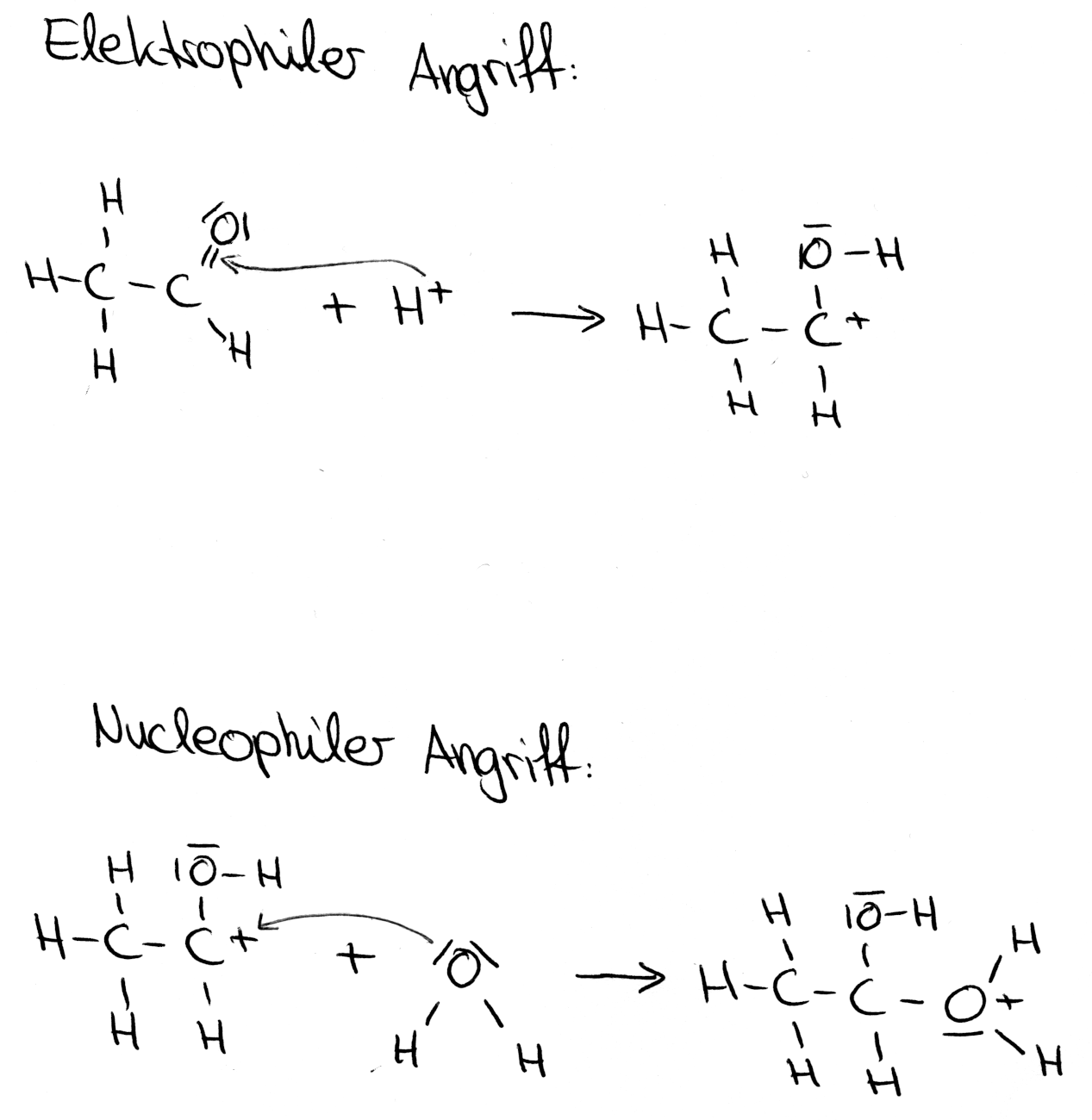
2) Elektrophile:
Elektrophile (Griechisch: ‚philos‘ = Freund ⇒ „Elektronenfreund“/ elektronenliebend) sind elektronenarme Ionen oder Moleküle, die aus diesem Grund wie Elektronenakzeptoren agieren. Der Angriff erfolgt an den Stellen, wo sich eine negative (Partial-) Ladung befinden. Dabei entsteht eine Atombindung mit dem Reaktionspartner. (Angriff: siehe Pfeil)
3) Nucleophile:
Nucleophile (Griechisch: ‚nukleos‘ = Kern; ‚philos‘ = Freund ⇒ „Kernfreund“/von positivem Kern angezogen) sind elektronenreiche Ionen oder Moleküle, die aus diesem Grund wie Elektronendonatoren agieren. Dieser Elektronenüberschuss kann neben der Ladung auch aufgrund von Doppelbindungen oder freien Elektronenpaaren vorkommen. Nucleophile Teilchen greifen die Stellen an, wo sich positive (Partial-) Ladungen befinden. Dabei bilden sich Atombindungen mit dem Reaktionspartner aus. (Angriff: siehe Pfeil)
Beispiele für Reaktionstypen und Vorgänge:
Halogenierung → Ein Wasserstoffatom an einer Kohlenstoffkette wird durch Substitution von einem Halogenatom ersetzt.
Alkylierung → Ein Wasserstoffatom an einer Kohlenstoffkette wird durch eine Substitution von einer Alkylgruppe ersetzt.
Dehydratisierung → Ein Wassermolekül wird durch Eliminierung von einer Kohlenstoffkette abgespalten.
Dehydrierung → Ein Wasserstoffmolekül wird durch Eliminierung von einer Kohlenstoffkette abgespalten.
Decarboxylierung → Ein Kohlenstoffdioxidmolekül wird durch Eliminierung von einer Kohlenstoffkette abgespalten.