Chemie
- Details
- Zugriffe: 28373
Name: Valentin Jost
I-Effekte:
Im Grunde unterscheidet man zwischen zwei verschiedenen I-Effekten, dem +I-Effekt (positiver induktiver Effekt) und dem –I-Effekt (negativer induktiver Effekt). Sie werden beide durch eine ungleichmäßige Verteilung der Elektronen in einem Molekül verursacht. Sie beruhen vor allem auf der Elektronegativität von Atomen in der Bindung.
+I-Effekt
Bei dem positiven induktiven Effekt werden Elektronen von einem Atom in Richtung eines anderen geschoben, sodass das Atom häufiger von den Bindungselektronen umgeben ist und deshalb etwas „negativer“ wird. Das elektronenschiebende Atom wird aus denselben Gründen „positiver“.
Dies passiert häufig bei C-Ketten, besonders wenn diese verzweigt sind. Man unterscheidet hierbei zwischen primären, sekundären und tertiären C-Atomen. Primär etc. sind Begriffe, die die Anzahl der umliegenden C-Atome angeben (also: primäres C-Atom=ein angrenzendes C-Atom etc.). Seitenketten (Methyl-, Ethylgruppen,…) sind unbedingt nötig um tertiäre C-Atome zu verursachen. Je mehr Atome ein Atom umgibt desto stabiler liegt es in der Bindung. Dies ist z.B wichtig um zu erkennen an welcher Stelle ein Halogen am ehesten angreifen würde.
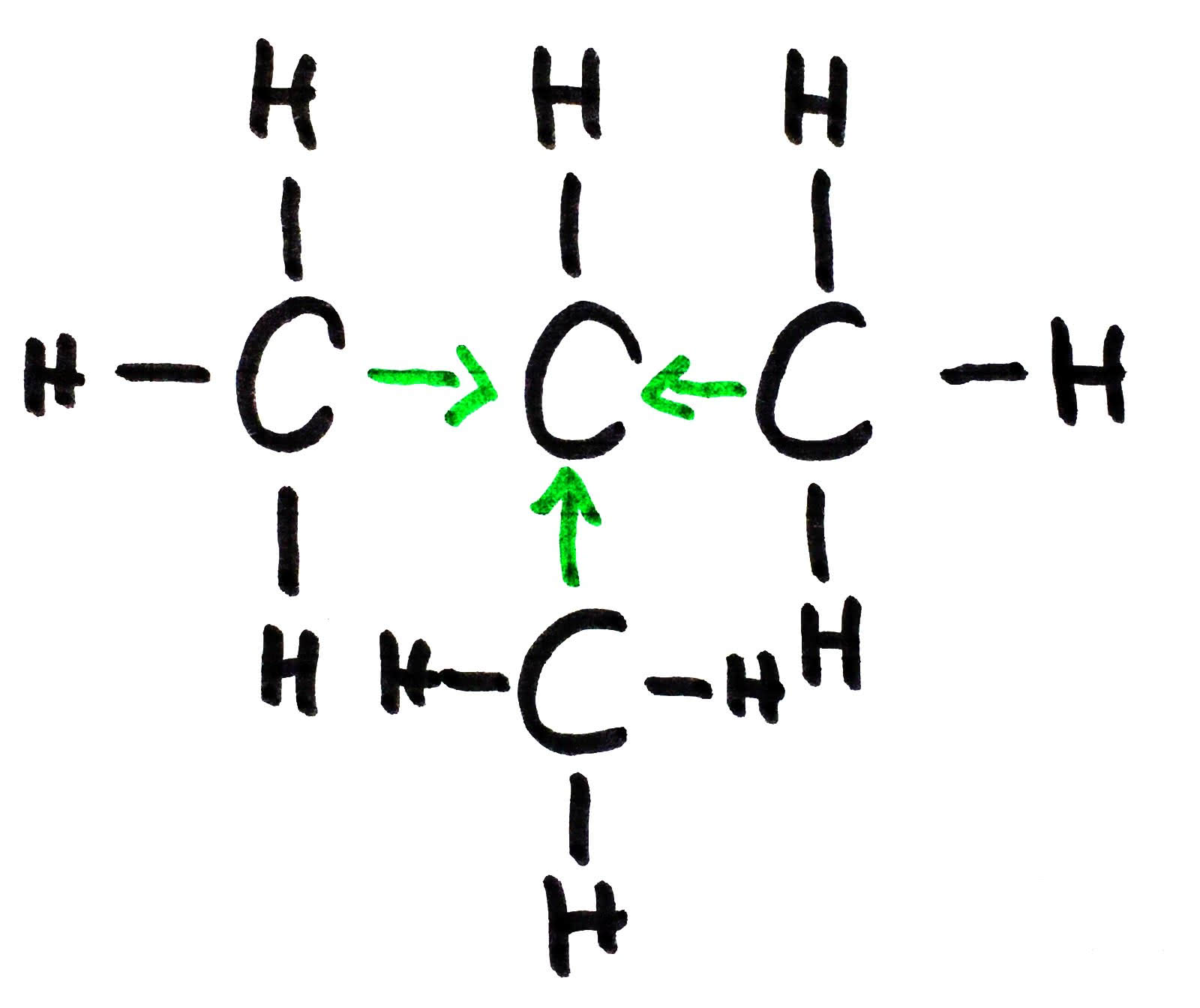
Dieses 2-Methylpropan zeigt einen elektronenschiebenden Effekt. Dabei wird das mittlere C-Atom stabilisiert. Durch die Stabilisierung binden an diesem angreifende Stoffe am wahrscheinlichsten.
-I-Effekt
Bei dem negativen induktiven Effekt ziehen Stoffe mit einer hohen Elektronegativität Elektronen in ihre Richtung und verursachen eine Umverteilung des Ladungsgleichgewichts. Besonders stark ziehen OH-Gruppen und Halogene an den Bindungselektronen.
Für die Stärke des Effektes ist die Elektronegativität verantwortlich. Bei einer hohen Elektronegativität können sich die Effekte nicht nur auf die direkt angrenzenden, sondern auch auf fortlaufende Atome auswirken. Allerdings nimmt die Stärke je Atom zum Quadrat ab. Man kann allerdings davon ausgehen, dass spätestens nach dem dritten Atom keine Auswirkungen mehr zu beobachten sind.
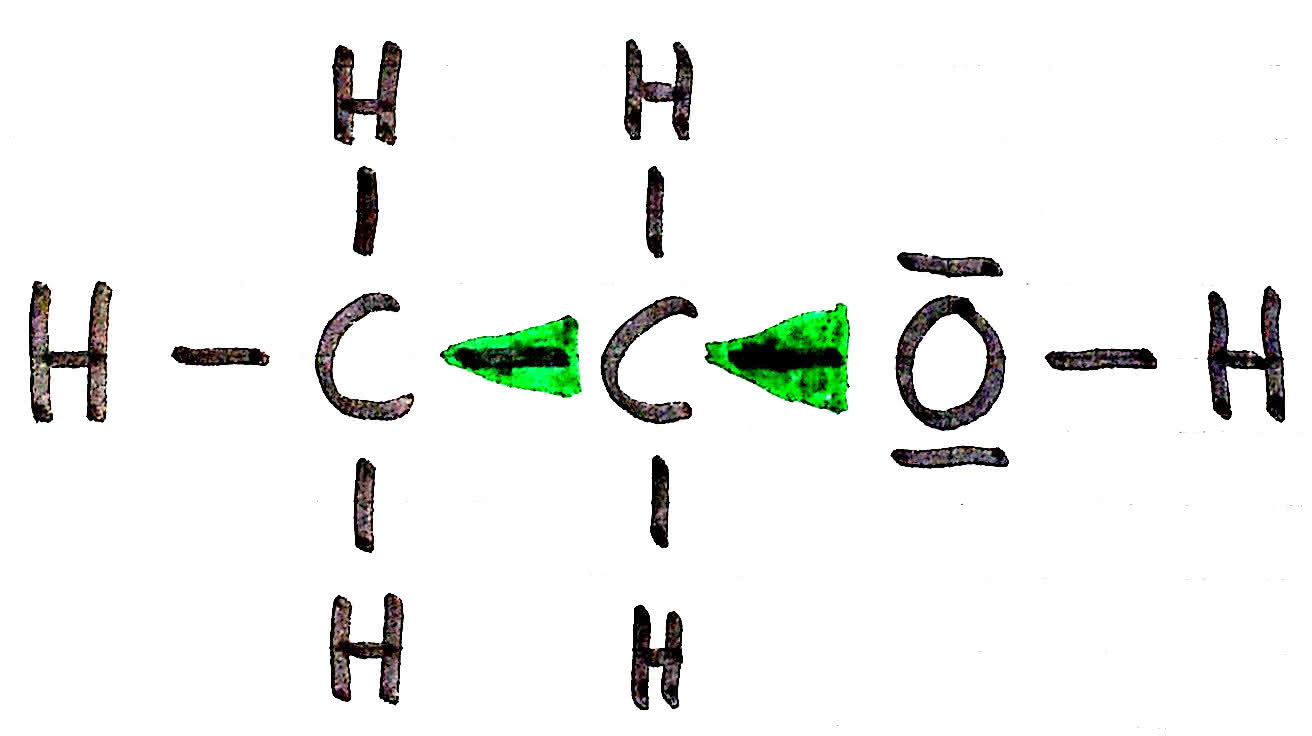
Die OH-Gruppe zieht an den Elektronen, der Bindung mit dem C-Atom. Das C-Atom wird dadurch positiver und zieht ebenfalls an den Elektronen des nächsten C-Atoms.
Auswirkungen
Die I-Effekte bewirken, dass andere Moleküle sich zum betroffenen Atom hinwenden oder sogar an diesem binden können. Außerdem können sie Auswirkungen auf die Säurestärke von Molekülen haben und die Abspaltung von Protonen erleichtern.
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
