Chemie
- Details
- Zugriffe: 83118
Name: Gabriel Engelhardt, 2015
Protolyse bei organischen Verbindungen
Wird ein Proton (H+) abgespalten, um danach an ein anderes Molekül bzw. Atom zu binden, wird dieser Vorgang Protolyse genannt. Ein Stoff, der Protonen abgibt, nennt sich Protonendonator oder auch Säure.
In der organischen Chemie besitzen Säuren funktionelle Gruppen, welche mindestens ein Proton abspalten können. Dies ist häufig eine Carboxygruppe (–COOH). Bei dieser kann ein H+-Proton, das an ein Sauerstoff-Atom gebunden ist, abgespalten werden.
Säurestärke/Acidität
Die Säurestärke oder Acidität ist von dem Ausmaß der Protolyse abhängig. Gibt eine Säure ihr/e Proton/en sehr leicht ab, so ist sie stark und ihre Acidität ist hoch. Gibt sie ihr/e Proton/en nur schwer ab, so ist sie folglich schwach und ihre Acidität ist gering.
Um die Säurestärke verschiedener Säuren zu vergleichen, beobachtet man die Protolyse einer bestimmten Säure in Wasser unter den gleichen Umständen. Durch Protolyse werden aus H2O-Molekülen H3O+-Ionen gebildet. Da die Säure dabei ein Proton abgibt, verliert sie ihren sauren Charakter und wird zur Base, da sie in der Lage ist Protonen aufzunehmen (Base=Protonenakzeptor).
Säure + Wasser ⇌ Base + H3O+
Da diese Reaktion in beide Richtungen verlaufen kann, stellt sich nach kurzer Zeit ein Gleichgewicht ein. Dabei stehen Säure und Base in einem gewissen Verhältnis zueinander. Gibt die Säure ihr Proton leicht ab, so ist die Basenkonzentration höher. Somit lässt sich das Ausmaß der Protolyse ausmachen, indem die Konzentration von Säure und Base verglichen wird. Aus diesem Verhältnis ergibt sich die Säurekonstante einer Säure KS.
Einfluss der I-Effekte auf die Säurestärke
Induktive Effekte(I-Effekte) innerhalb organischer Moleküle, mit protonierender funktioneller Gruppe(organische Säuren), sorgen für eine Umverteilung von intermolekularen Elektronen (siehe Artikel: I-Effekte).
Gibt es überwiegend I-Effekte, die Elektronen vom abspaltbaren Wasserstoff wegbewegen, so wird die Bindung zwischen Wasserstoff und angrenzendem Atom (bei Carbonsäure Sauerstoff) entsprechend geschwächt. Somit lässt sich das Proton (H+) leichter abspalten und die Acidität steigt.
Sorgen die I-Effekte für ein Schieben der Elektronen in Richtung des Wasserstoffes, so wird die Bindung zwischen Wasserstoff und angrenzendem Atom gestärkt und der saure Charakter des Stoffes nimmt ab, da sich das Proton (H+) leichter abspalten lässt.
Beispiel für den Einfluss von Substituenten auf die Säurestärke:
Ein 2,2,2-Trifluorethan-1-ol besitzt starke -I-Effekte, welche Elektronen von der Alkoholgruppe wegbewegen. Somit wird die Bindung zwischen Sauerstoff und Wasserstoff geschwächt und das Molekül bekommt Sauren Charakter, da eine Protolyse wahrscheinlicher wird.
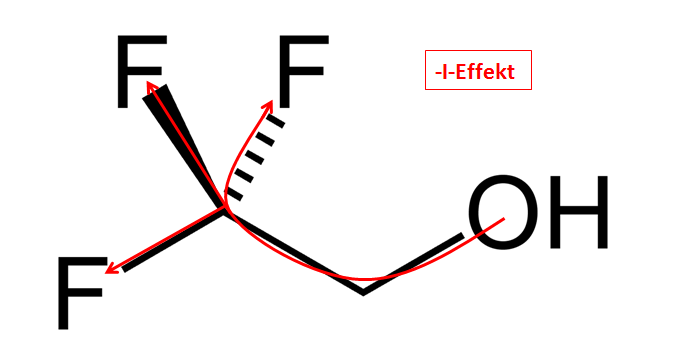
2,2,2-Trifluorethan-1-ol
Lizenz: Gemeinfrei. Autor: Benjah-bmm27. Quelle: http://commons.wikimedia.org/wiki/File:2,2,2-trifluoroethanol.png
Ein Nonan-1-ol entspricht jedoch dem Gegenteil. Hier könnte theoretisch das H+-Proton, der Alkoholgruppe, abgespalten werden. Jedoch schieben die +I-Effekte der CH2- bzw. CH3-Gruppen Elektronen in Richtung der Alkoholgruppe. Aufgrund dessen wird die Bindung zwischen Wasser- und Sauerstoff gestärkt, eine Protolyse wird erschwert und der saure Charakter nimmt ab. In diesem Fall ist eine Protolyse annähernd unmöglich.
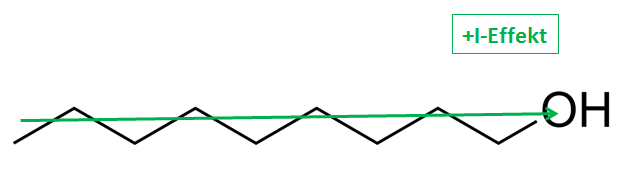
Nonan-1-ol
Lizenz: Gemeinfrei. Autor: Edgar181. Quelle: http://commons.wikimedia.org/wiki/File:1-Nonanol.png
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik
