Chemie
- Details
- Zugriffe: 10987
Name: Olia Nematpur & Keller, Kevin 2022-03
Gelatine, die bestimmt wichtigste Zutat für Omas Erdbeergelee oder ihre geliebte Obsttorte. Was ist aber Gelatine genau?
Gelatine ist ein geschmacksneutrales, tierisches Eiweiß (Polypeptid), das außer Tryptophan alle essentiellen Aminosäuren enthält.
Sie ist also ein Stoffgemisch aus aromaneutralen Proteinen. Die Grundlage ist dabei hydrolysiertes Kollagen, das aus dem Bindegewebe von beispielsweise Rindern und Schweinen, als Hauptbestandteil zugrunde liegt.
Benutzt wird es beispielsweise zur Bindung von Parfaits und spielt deshalb in der Lebensmittelindustrie eine signifikante Rolle.

Gummibärchen bestanden bis vor wenigen Jahren aus Gelatine. Heute sind die meisten aus veganen Eiweißen.
Quelle Bild: Creative Commons Attribution-Share Alike 2.5 Generic license; Author: Thomas Rosenau; https://commons.wikimedia.org/wiki/File:Gummy_bears.jpg; thank you!
Gewinnung von Gelatine
Zur Gewinnung wird das zunächst unlösliche Bindegewebe von Haut und Knochen von Schweinen und Rindern aber auch von Geflügel und Fischen einem Aufschlussverfahren (Hydrolyse) unterworfen, das die Peptid-Bindungen aufspaltet, sodass sich das so wasserlöslich gemachte Kollagen extrahieren lässt.
Der Aufschluss kann durch Kochen oder durch Behandlung mit Säuren und Basen und anschließender Extraktion (industriell) erfolgen. Gelatine kann 1-2 % Mineralien und bis zu 15 % Wasser enthalten.
Gelatine wird durch chemisch - thermische Verfahrensschritte aus Kollagen gewonnen. Vorgehensweise ist wie folgt:
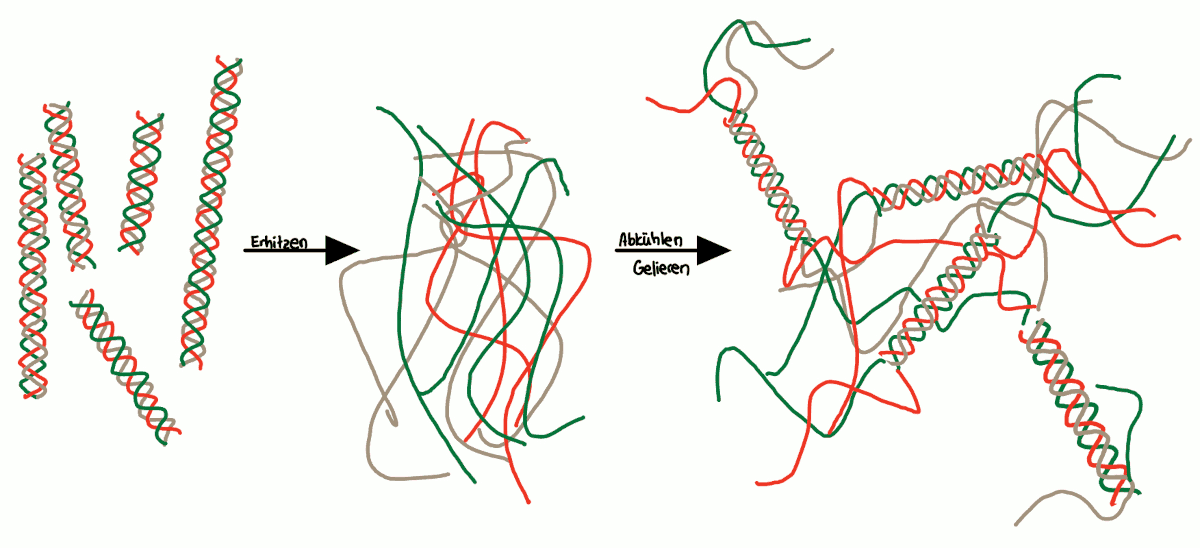
Bindungen, die das Kollagen stabilisieren, werden teilweise zerstört. Die helikale Struktur der einzelnen Kollagenstränge wird zerstört. Die thermische Bewegung kann die Kräfte, die die dreisträngige Helix stabilisieren überspielen und es entsteht Gelatine - eine gestörte Molekülstruktur aus Knäueln, deren Faltung beim Abkühlen vom Zufall bestimmt ist.
Folgende Bindungen können gestört werden:
1. kooperative Wechselwirkungen, d.h. die helikale Form beruht auf vielen sich verstärkenden Bindungen, die einzeln relativ schwach sind, wie z.B.:
- Wasserstoffbrückenbindungen sind einerseits zwischen der peptidischen Amino- gruppe des Glycins und der peptidischen Carbonylgruppe von den anderen beiden Ketten in der Helix und andererseits zwischen den Hydroxylgruppen der Hydroxyp- rolinresten und Wasserstoffatomen zu finden.
- Überlappungen zwischen hydrophoben Glycin-Prolin-Hydroxyprolin-reichen Struk- turelementen und hydrophilen Bereichen (hoher Anteil an polaren, negativ und positiv geladenen Aminosäuren)
- Anziehung durch Van-der-Waals Kräfte einzelner Strukturelemente.
Eigenschaften von Gelatine
- Gelatine kann 1-2% anorganische Stoffe und bis zu 15% Wasser enthalten.
- Gelatine quillt in Wasser und löst sich beim Erwärmen ab etwa 50 °C auf und wenn sie über längere Zeit auf mindestens 80°C erhitzt wird, verliert sie die Gelierkraft.
- Sie ist ein Hydrokolloid, bei dem das (beim Abkühlen) gebildete Gel beim Erwärmen wieder flüssig wird.
- Wenn sie abkühlt und daraufhin wieder erhitzt wird, wird das entstandene Gel wieder flüssig, wobei es sich um einen sogenannten „Gel-Sol-Prozess“ handelt, der auch dafür sorgt, dass Gummibärchen im Mund zergehen und nicht klebrig werden. Dieser Gel-Sol-Übergang nennt man auch thermoreversibel.
- Gelatine ist temperaturempfindlich. Wird sie längere Zeit über 80 °C erhitzt, wird sie hydrolysiert und verliert damit mehr und mehr ihre Gelierkraft
- Wie alle anderen Proteine besitzt auch Gelatine amphotere Eigenschaften. Deshalb gibt es einen pH-Wert, an dem die (positive) elektrische Ladung der Aminogruppen so groß ist wie die (negative) Ladung der Carboxygruppen, weshalb bei dem pH-Wert die positive elektrische Ladung der Aminogruppen genauso groß ist wie die negative Ladung der Carboxygruppen. Der genaue pH-Wert ist dabei abhängig von der Herstellungsart; wenn es sich um einen sauren Aufschluss handelt, bewegt sich der pH-Wert im Bereich von 6 bis 9,5, bei einem alkalischen Aufschluss zwischen 4,7 und 5,6.
Herstellung von Gelatine
Zur Herstellung werden zunächst von Haut und Knochen von primär Schweinen und Rindern durch Aufschlussverfahren die Peptid-Bindungen aufgespalten, damit sich das Kollagen extrahieren lässt. Der Aufschluss selbst kann dabei beispielsweise durch Kochen oder durch Behandlung mit Säuren und Basen und eine anschließende industrielle Herstellung geschehen.
Die industrielle Herstellung verläuft dabei so, dass das vorhandene Bindegewebe (wie etwa Rinderspalt sowie Häute und Knochen) zerkleinert und daraufhin entweder mit einer Säure oder eine Base behandelt wird. Die Säurebehandlung dauert dabei in der Regel nur einen Tag, bei dem das Material mit Salz- oder Schwefelsäure behandelt wird, während es bei der Basenbehandlung bis zu mehreren Monaten unter Bildung von Kalkmilch und Ammoniak behandelt wird. Nach diesem Schritt wird das Material in zunehmend wärmerem Wasser aufgelöst, sodass die Extraktion beginnen kann, da bei steigender Temperatur die Gelierkraft abnimmt. Daraufhin werden die Extrakte gereinigt, indem Fett, Fasern und verbliebene Säurereste entfernt werden. Im nächsten Schritt wird die Gelatinelösung in Vakuumtrocknern zu einer honigartigen Konsistenz eingedickt und sterilisiert, abgekühlt und getrocknet. Nachdem die Masse überdies einen Trockentunnel durchläuft, ist sie auf einen Wassergehalt von 10 bis 15% getrocknet und kann, nachdem sie zur entsprechenden Größe gemahlen wurde, zum Einsatz in verschiedenen Produkten kommen, auf die unten noch genauer eingegangen wird.
In Europa wird 80% der Gelatine aus Schweineschwarten hergestellt, allerdings kann Gelatine auch aus Fischhäuten entnommen werden, was zum Teil getan wird, um es Kulturen, die auf Fleisch verzichten, zu ermöglichen, Produkte mit Gelatine zu erwerben. Jedoch wird dies von vielen kritisch gesehen, da allergische Reaktionen auf Fisch weitverbreitet sind und es deshalb in der Vergangenheit oft zu Problemen kam.
Verwendung von Gelatine
Gelatine wird teilweise in Halbfettprodukten und Lightprodukten wie Halbfettmargarine, Halbfettbutter und fettreduzierten Käsesorten verarbeitet, außerdem als Geliermittel zur Herstellung von Süßwaren wie Gummibärchen, Weingummis und Marshmellows. Des Weiteren kann sie in Backwaren (Tortenguss) und Desserts (z. B. Götterspeise, Mädchenröte, Schlagsahne), in Fleisch-, Fisch- und Wurstwaren wie zum Beispiel Sülze, Pfefferminzbonbons enthalten sein.
Außerdem kommt sie bei Getränken wie Wein, Apfelwein, Essig und allen nicht naturtrüben Fruchtsäften, sowie in manchen Ländern bei Bier zum Einsatz. Durch die Gelatine in den Getränken zeigen sie eine schöne Farbe auf. Sie dient der Entfernung von Trübstoffen sowie zur Verringerung des Gerbstoffanteils bei der Weinherstellung. Sie dient als Ersatz für Lysozym und Kasein.
Gelatine in der Medizin / Pharmazie
Gelatine wird zur Herstellung von Hart- und Weichkapseln verwendet. In solche Gelatinekapseln wird der Arzneistoff, gegebenenfalls mit erforderlichen Hilfsstoffen verarbeitet, eingefüllt. Gelatine kann auch als Verdickungsmittel zur Viskositätserhöhung von flüssigen Arzneizubereitungen eingesetzt werden. Aus der Vielzahl der Gelatinetypen werden praktisch nur Gelatine A (durch sauren Aufschluss gewonnen) bzw. Gelatine B (durch alkalischen Aufschluss gewonnen) eingesetzt. In der Medizintechnik dient Gelatine unter anderem zur Beschichtung von Implantaten wie beispielsweise Gefäßprothesen. In der Vergangenheit wurde Gelatine in Form von Polygelin auch in Impfstoffen verwendet, was jedoch aufgrund der allergischen Reaktion auf Gelatine vonseiten vieler Patienten in den letzten Jahren abgenommen hat.
Sonstige Verwendung von Gelatine
Gelatine spielte zudem in der Frühzeit der Fotografie, als noch auf Film fotografiert wurde, eine elementare Rolle, da sie auf Filmmaterial und Fotopapieren enthalten war, wodurch auch das sogenannte „trockene Gelatineverfahren“ entstand, welches bei der Herstellung von Negativmaterial zum Einsatz kam. Davon abgesehen kommt Gelatine auch bei Maskenbildnerei für Film und Theater zum Einsatz sowie in der Sportart Paintball als Hülle für die mit Farbe gefüllten Bälle und auch als Beschichtung von Geigen.
Gelatine Ersatzstoffe
Die Tatsache, dass Gelatine nicht vegetarisch ist, führte immer wieder dazu, dass bestimmte Menschengruppen Gelatine gemieden haben. Stattdessen wird heute auf pflanzliche Geliermittel, wie etwa Polysaccharide zurückgegriffen oder die aus Früchten gewonnen Pektine. Um Flüssigkeiten zu klären, können auch Ton, Kieselgur oder andere Stoffe verwendet werden und in der Pharmaindustrie werden inzwischen auch gelatinefreie Produkte beworben.
P.S. Nun wisst ihr was Gelatine ist und wie es zustande kommt. Vielleicht könnt ihr beim nächsten Kaffee und Kuchen Treffen am Sonntag bei der Oma mit eurem wissen angeben :p

- Selektivität und Spezifität von Katalysatoren
- Herstellung von Maßlösungen
- I-Effekte beeinflussen die Säurestarke von Carbonsäuren
- Organische Chemie: Oxidative Fettumwandlung (Ranzigwerden von Fetten)
- Organische Chemie: Alkane - feste Alkane // Wachse und Paraffine
- Organische Chemie: Alkane - flüssige Alkane
- Organische Chemie: Alkane - gasförmige Alkane
- Organische Chemie: Alkanole (Alkohole)
- Organische Chemie: Alkene und Alkine
- Organische Chemie: Alkohol und seine Wirkung auf Menschen
- Organische Chemie: Alkoholate
- Organische Chemie: Alkohole: Ethanolherstellung durch alkoholische Gärung und großtechnische Produktion
- Organische Chemie: Aminosäuren - Peptidbindung, Typen, Aufbau, Reaktionen
- Organische Chemie: Anorganische Ester
- Organische Chemie: Aufgaben und Übungen zur Nomenklatur bei organischen Verbindungen
- Organische Chemie: Benzin und Diesel
- Organische Chemie: Bestimmung von Schmelz- und Siedepunkten
- Organische Chemie: Biogasanlagen
- Organische Chemie: Brennbarkeit von Kohlenwasserstoffen
- Organische Chemie: Carbonsäuren: homologe Reihe, Verwendung
- Organische Chemie: Carbonylverbindungen - Aldehyde
- Organische Chemie: Carbonylverbindungen - Ketone
- Organische Chemie: chemische Nachweise bei organischen Verbindungen
- Organische Chemie: Cis-/ trans-Isomerie und E/Z-Isomerie
- Organische Chemie: Cycloalkane und Cykloalkene
- Organische Chemie: Darstellungsweisen organischer Verbindungen
- Organische Chemie: Der Einfluss der I-Effekte auf die Säurestärke
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik