Chemie
- Details
- Zugriffe: 29946
Name: Emily, 2018-05
Puffer sind spezielle Lösungen, welche trotz Zugabe von Säure oder Base nicht oder nur wenig ihren pH-Wert ändern. Sie können mit Hilfer der Henderson-Hasselbalch-Gleichung berechnet werden.
Grundlagen: Säure-Base-Puffer und Puffersysteme
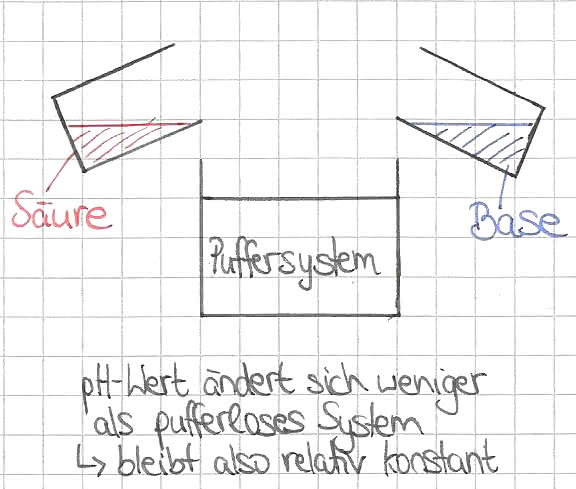
Als Puffersystem wird in der organischen Chemie eine Lösung bezeichnet, die nach der Zugabe einer Säure bzw. Base nur eine geringe pH-Wert-Veränderung aufweist. Da diese meist als wässrige Lösung vorkommen, spricht man hier auch von Pufferlösungen. Im besten Fall kann eine Pufferlösung dafür sorgen, dass der pH-Wert trotz Zugabe einer Säure/ Base gleich bleibt.
Pufferlösungen bestehen entweder aus schwachen Basen und deren korrespondierenden Säuren oder aus schwachen Säuren und den korrespondierenden Basen.
Die Puffersäure arbeitet als Protonendonator um die Hydroxidionen zu neutralisieren, während die korrespondierende Base die Protonen aufnimmt
Diese werden als Puffersäure bzw. -base bezeichnet. Sie bilden gemeinsam das Puffersystem.
Wird einem Puffersystem geringe Mengen an Hydroxid- bzw. Oxoniumionen zugeführt, so ändert sich dessen pH-Wert nur wenig. Dies zeigt, dass die jeweils zugeführten Ionen in ihrer Wirkungsweise abgeschwächt werden.
Bei der Zugabe der Ionen in reines Wasser, verändert sich der pH-Wert jedoch sehr stark.
Die Pufferlösung weist einen pH-Wert auf, der in etwa dem pKs-Wert der schwachen Säure gleicht.
Puffersystemarten
Es gibt zwei Arten von Puffersystemen: offene und geschlossene Puffersysteme.
Bei offenen Puffersystemen (z. B. Kohlensäure-Puffer) kann der pH-Wert durch das Abgeben eines Stoffes stabil gehalten werden.
Bei geschlossenen Puffersystemen hingegen kommt es zu keinem Austausch mit der Umwelt, sodass alle Ausgangsstoffe auch zum Ende hin noch vorhanden sind.
Henderson-Hasselbach-Gleichung:
Aus dem Massenwirkungsgesetz folgt:
Ks = c(H3O+) · c(A-) / c(HA)
Diese Formel des Säure-Base-Gleichgewichts lässt sich so umstellen, dass man die Henderson-Hasselbach-Gleichung daraus erhält:
pH = pKs + lg c(A-) / c(HA)
Aus der Gleichung lassen sich mehrere Informationen ableiten:
- der pH-Wert steht in Abhängigkeit zum pKs-Wert der Puffersäure
- das Konzentrationsverhältnis der Puffersäure zur Pufferbase wird durch den pH- Wert bestimmt und umgekehrt
- bei gleicher Konzentration von Puffersäure und -base ist der pH-Wert gleich dem pKs-Wert.
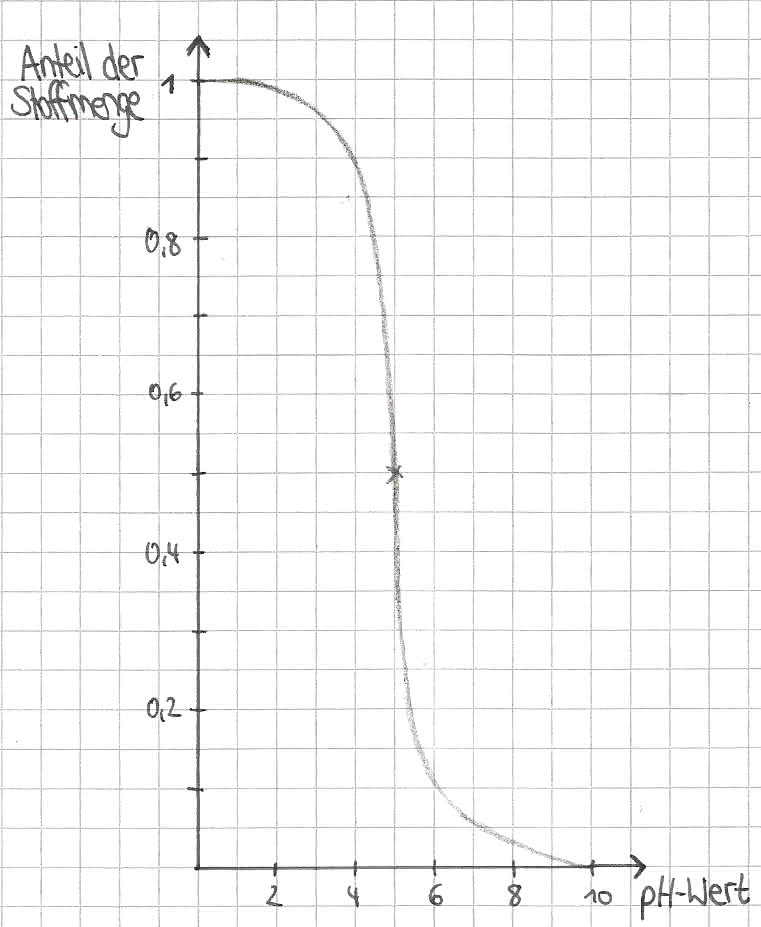
Die Pufferungskurve
Die oben behandelte Henderson-Hasselbach-Gleichung kann durch eine Pufferungskurve grafisch veranschaulicht werden.
An der Stelle, an der der pH-Wert und pKs-Wert gleich sind, ist die Steigung am geringsten (in der Graphik entspricht diese Stelle dem Wendepunkt). Bei anfänglicher Veränderung der Konzentrationen von Base und Säure kommt es aufgrund des Puffersystems nur zu geringen Abweichungen der Steigung.
Pufferkapazität
Die Pufferkapazität β gibt die Stoffmenge an benötigten Hydroxid- bzw. Hydronium-Ionen an, die in einen Liter einer Lösung gegeben werden muss, um den pH-Wert um eine Einheit zu erhöhen oder zu senken. Sie wird in der Einheit Mol pro Liter angegeben.
Die Neutralisation von Oxonium- oder Hydroxid-Ionen durch ein Puffersystem ist nur bis zu einem bestimmten Punkt möglich.
Wenn der größte Teil der Puffersäure bzw. der korrespondierenden Base umgesetzt wurde, ist die Pufferkapazität erschöpft.
An der Stelle pH=pKs ist die Wirkung der Pufferlösung am besten.
Als Hilfestellung kann man sich merken, dass die Pufferkapazität erschöpft ist, wenn das Konzentrationsverhältnis der Säure und Base den Wert 1 zu 10, bzw. 10 zu 1 übersteigt.
Beispiele einiger wichtiger Puffer:
- Essigsäure-Acetat-Puffer
- Phosphatpuffer
- Kohlensäure-Hydrogencarbonat-Puffer
Verwendungsbereich/ Einsatz von Säure-Base-Puffern
- Im menschlichen Körper sind Puffersysteme nötig, um zum Beispiel den pH-Wert des Blutes konstant zu halten.
- Mithilfe eines Puffers können pH-Wert-Messgeräte neu kalibriert werden.
- Bedeutend sind Puffersysteme außerdem in der technischen Chemie wie beispielsweise bei der Galvanisierung.
- Anorganische Chemie: Säurestärke (pKs) und Basenstärke (pKb)
- Anorganische Chemie: Schwefel
- Anorganische Chemie: Schwefelsäure
- Anorganische Chemie: Stickstoff
- Anorganische Chemie: Struktur von Salzen, Ionengitter und Ionenbildung
- Anorganische Chemie: Übungsaugaben zum Massenwirkungsgesetz (MWG)
- Anorganische Chemie: Vergleich von Ionenbindung und Atombindung
- Anorganische Chemie: Wasserstoff
- Anorganische Chemie: Wie berechnet man Neutralistionsaufgaben (Beispielaufgaben)
- Anorganische Chemie: Wie funktioniert der Lithium-Ionen-Akku?
- Anorganische Chemie: Zink
- Anorgansiche Chemie: Redoxreaktion - Beispielaufgaben
- Biochemie: Biokatalysatoren (Enzyme)
- Chemie: Oxidationszahlen und deren Bestimmung (!)
- Farbigkeit und Molekülstruktur
- Glossar: Fachbegriffe der anorganischen und organischen Chemie mit Erklärungen
- Komplexchemie: Anwendungen der Komplexchemie
- Komplexchemie: Aquakomplexe
- Komplexchemie: Aufbau von Komplexen
- Komplexchemie: Chelatkomplexe
- Komplexchemie: Historischer Abriss der Entdeckung der Komplexchemie
- Komplexchemie: In der Natur vorkommende (biologische) Komplexverbindungen
- Komplexchemie: Komplexe Gleichgewichtsreaktionen und die Stabilitätskonstanten
- Komplexchemie: Komplexstabilitätskonstante und Komplexzerfallskonstante
- Komplexchemie: Ligandenaustauschreaktionen
- Komplexchemie: Nomenklatur (Benennung) von Komplexen
- Komplexchemie: Wasserenthärtung
- Ökologische, ökonomische und soziale Nachhaltigkeit in Chemie
- Organische Chemie: Gelatine
- Selektivität und Spezifität von Katalysatoren
- Herstellung von Maßlösungen
- I-Effekte beeinflussen die Säurestarke von Carbonsäuren
- Organische Chemie: Oxidative Fettumwandlung (Ranzigwerden von Fetten)
- Organische Chemie: Alkane - feste Alkane // Wachse und Paraffine
- Organische Chemie: Alkane - flüssige Alkane
- Organische Chemie: Alkane - gasförmige Alkane
- Organische Chemie: Alkanole (Alkohole)
- Organische Chemie: Alkene und Alkine
- Organische Chemie: Alkohol und seine Wirkung auf Menschen
- Organische Chemie: Alkoholate
- Organische Chemie: Alkohole: Ethanolherstellung durch alkoholische Gärung und großtechnische Produktion
- Organische Chemie: Aminosäuren - Peptidbindung, Typen, Aufbau, Reaktionen
- Organische Chemie: Anorganische Ester
- Organische Chemie: Aufgaben und Übungen zur Nomenklatur bei organischen Verbindungen
- Organische Chemie: Benzin und Diesel
- Organische Chemie: Bestimmung von Schmelz- und Siedepunkten
- Organische Chemie: Biogasanlagen
- Organische Chemie: Brennbarkeit von Kohlenwasserstoffen
- Organische Chemie: Carbonsäuren: homologe Reihe, Verwendung
- Organische Chemie: Carbonylverbindungen - Aldehyde
- Organische Chemie: Carbonylverbindungen - Ketone
- Organische Chemie: chemische Nachweise bei organischen Verbindungen
- Organische Chemie: Cis-/ trans-Isomerie und E/Z-Isomerie
- Organische Chemie: Cycloalkane und Cykloalkene
- Organische Chemie: Darstellungsweisen organischer Verbindungen
- Organische Chemie: Der Einfluss der I-Effekte auf die Säurestärke
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik