Chemie
- Details
- Zugriffe: 8241
Name: Hopemaster, 2020-11
Batterien sind galvanische Zellen, meist mit unterschiedlichen Halbzellen. Baut man hingegen galvanisches Element, welches aus zwei identischen Halbzellen besteht, fließt nur dann ein (schwacher Strom), wenn die Lösungen eine unterschiedliche Konzentration haben.
Beispiel: Das Kupfer-Konzentrationselement
Das Potential zweier Kupferhalbzellen soll verglichen werden. Dazu nimmt man zwei Zellen mit dem Konzentrationsunterschied 1:10. Es werden zwei identische Kupferstäben verwendet.
Die notwendigen Kupfersulfatlösungen:
Lösung 1: 50ml Wasser werden zu 5g CuSO4 gegeben.
Lösung 2: 1/10 der Konzentration von Lösung 1
Eine Messung des Potentials ergibt eine Spannung von 0,031V (obwohl gleiche Metalle und in beiden Fällen eine Kupfersulfatlösung vorliegt)
Eine solche Anordnung (gleices Metall und gleicher Elektrolyt) nennt man "Konzentrationselement" bzw. "Konzentrationskette"
- Zwischen den beiden Halbzellen, welche das gleiche Element und die gleiche Elektrolytlösung enthalten und sich nur in der Konzentration der Elektrolytlösung unterschieden, bildet sich eine Spannung.
- Das Potential jeder Halbzelle ist dabei von der Konzentration der Salzlösung abhängig!
- Durch die Redoxreaktion kommt es zum Konzentrationsausgleich zwischen den beiden Halbzellen.
- Es gilt: Die schwächer konzentrierte Lösung ist die unedlere und somit der negative Pol (Anode - Ort der Oxidation).
Man kann mit diesem Wissen nun auch Konzentrationselemente mit verschiedenen Metallen herstellen.
Nernst und seine Gleichung
Walther Hermann Nernst (1864 - 1941) hat sich mit diesem Phänomen beschäftigt. Er wollte den mathematischen Zusammenhang dahinter finden. Er bemerkte, dass bei Spannungsmessungen mit Halbzellen gleicher einwertiger Elemente (so wie Ag+)eine Spannung von 0,059 V pro Zehnerpotenz Konzentrationsunterschied zwischen den Halbzellen gemessen wird. Sind die Ionen hingegen zweiwertig (so wie Cu2+), so ist die Spannung nur halbiert (0,0295 V).
Er stellte die nernstgleichung auf, welche in besonders in Schulen folgendermaßen vereinfacht wird:
0,059V c(ox)
ΔE (Red/Ox) = E0 (Red/Ox) + ———— · lg ———
1 c(red)
• n = Wertigkeit des jeweiligen Ions
• statt c(ox)/c(red) bzw. c(Anode)/c(Kathode)
• Der Faktor 0,059V ist ein Proportionalitätsfator bei Standardtemperatur 298K (=25°C) gilt.
• Anstelle von ΔE wird in manchen Büchern auch ΔU (für Spannung) oder EMK verwendet.
Vereinfachungen der Nernstgleichung:
Nernstgleichung für eine Metallhalbzelle bei 25°C:
0,059V c(Men+)
E = E0 + ———— · lg ——————
n 1 (mol/l)
(1 mol/l, als Vereinfachung für feste Metalle)
Nernstgleichung für eine Wasserstoffhalbzelle bei 25°C:
0,059V c(H+)
E = E0 + ———— · lg ——————
1 1 (mol/l)
Nernstgleichung für eine Nichtmetallhalbzelle bei 25°C:
Bei Nichtmetallen bildet in der Regel die reduzierte Form (und nicht die oxidierte wie bei den Metallen) das (An-)Ion.
0,059V 1 (mol/l)
E = E0 + ————— · lg ——————
n c(Anionn–)
Berechnung der Spannung von zwei Halbzellen in einer Konzentrationskette nach Nernst
Eselsbrücke für zwei Metallhalbzellen des gleichen Ions/Metalls: Die verdünntere Lösung ist die Anode (die oxidierte, unedlere Form), die konzentrierte Lösung ist die Kathode (also die reduzierte, edlere Form)!
Beachte: c(red)An und c(red)Kat sind in der Regel Metalle (elementare Form) und werden vereinfacht jeweils = 1 gesetzt!
0,059V c(ox)
E(Kat) = E0 (Red) + ———— · lg ————
n c(red)
0,059V c(ox)
E(An) = E0 (Ox) + ———— · lg ————
n c(red)
Die beiden Ergebnisse werden nun nach der folgenden Formel subtrahiert:
ΔE = E(Kathode) - E(Anode)
Anwendung der Nernst-Gleichung in drei Schritten
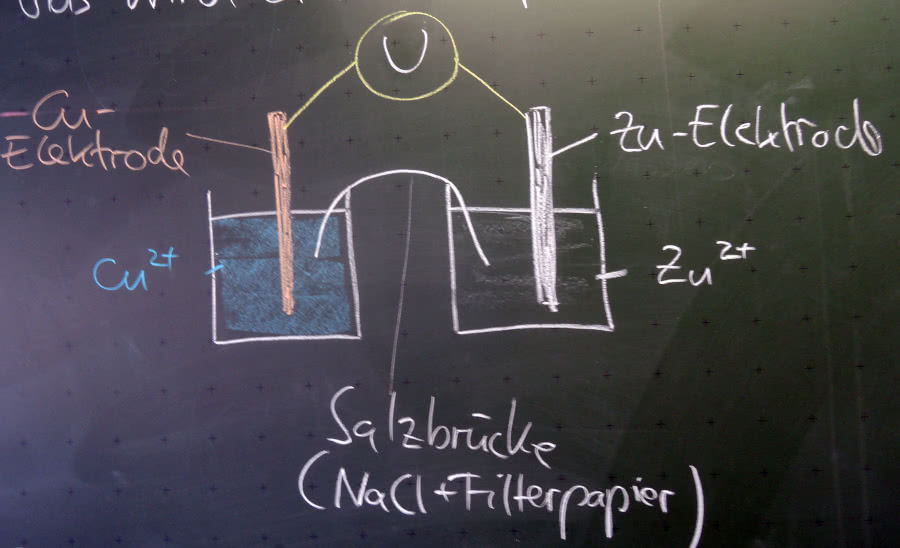
Die Spannung in einem Daniell-Element soll gemessen werden:
In dem Daniell-Element liegen die folgenden Konzentrationen vor:
c(Zinkionen) = 0,4 mol/l
c(Kupferionen) = 1·10-3 mol/l.
Bestimme die Spannung!
1. Reaktionsgleichung aufstellen und berechnen von ΔE für 1 molare Lösungen:
red: Cu2+ + 2e– ---> Cu E0 = 0,34V
ox: Zn ---> Zn2+ +2e– E0 = -0,76V
—————————————————————
Redox: Zn + Cu2+ ---> Cu + Zn2+
ΔE = E(Kathode) - E(Anode) = 0,34V - (-0,76V) = 1,1V
2. Berechnung der Spannungen der beiden Halbzellen:
0,059V c(ox)
EKat = E0Kat + ———— · lg ————— =
n c(red)
0,059V [Cu2+]
= 0,34V + ———— · lg ————— = 0,25V
2 [Cu]
[Cu] = 1, da es ein Feststoff ist
sowie:
0,059V c(ox)
EAn = E0An + ———— · lg ————— =
n c(red)
0,059V [Zn2+]
= -0,76V + ———— · lg ————— = - 0,77V
2 [Zn]
[Zn] = 1, da es ein Feststoff ist
Man setzt nun die beiden Teilergebnisse in die Gesamtgleichung:
3. Berechnung ΔE
ΔE = E(Kathode) - E(Anode) = 0,25V - (-0,77V) = 1,02V
- Anorganische Chemie: Krypton
- Anorganische Chemie: Kupfer und Kupfergewinnung
- Anorganische Chemie: Legierungen
- Anorganische Chemie: Löslichkeit und Löslichkeitsgleichgewichte
- Anorganische Chemie: Metalle - Alkalimetalle
- Anorganische Chemie: Metalle - Allgemeine Übersicht, Eigenschaften, Verwendung
- Anorganische Chemie: Metalle - Aluminium und Aluminiumverbindungen
- Anorganische Chemie: Metalle - Eisen und Eisenverbindungen
- Anorganische Chemie: Metalle - Erdalkalimetalle
- Anorganische Chemie: Metalle - Gold
- Anorganische Chemie: Metalle - Korrosion und Korrosionsschutz
- Anorganische Chemie: Metalle - Kupfer und Kupferverbindungen
- Anorganische Chemie: Metalle - Uran
- Anorganische Chemie: Metalle und die Metallbindung
- Anorganische Chemie: Oxidationsstufen des Mangans
- Anorganische Chemie: Periodensystem (!)
- Anorganische Chemie: pH-Abhängigkeit von Redoxpotentialen (über die Nernst-Gleichung)
- Anorganische Chemie: pH-Elektrode & elektrochemische pH-Wert-Bestimmung
- Anorganische Chemie: pH-Wert (und pOH-Wert)
- Anorganische Chemie: Phosphor
- Anorganische Chemie: Photovoltaik und Brennstoffzelle
- Anorganische Chemie: Protolyse von Phosphorsäure
- Anorganische Chemie: Protolysereaktionen bei Salzen (Säure-Base Reaktionen)
- Anorganische Chemie: Reaktion von Säuren und Basen mit Wasser
- Anorganische Chemie: Reaktionsgeschwindigkeit und Messung der Reaktionsgeschwindigkeit
- Anorganische Chemie: Reaktionsgeschwindigkeit, Momentangeschwindigkeit und Messung (sowie HWZ)
- Anorganische Chemie: Reaktionsgeschwindigkeitsmessung von Thiosulfationen mit Säure
- Anorganische Chemie: Redoxreaktionen aufstellen
- Anorganische Chemie: Redoxreaktionen im Alltag
- Anorganische Chemie: Salpetersäure HNO₃ - Herstellung, Verwendung, Eigenschaften
- Anorganische Chemie: Salpetrige Säure
- Anorganische Chemie: Salze
- Anorganische Chemie: Salzherstellung durch Neutralisation
- Anorganische Chemie: Sauerstoff
- Anorganische Chemie: Sauerstoffsäuren des Chlors
- Anorganische Chemie: Sauerstoffsäuren des Phosphors
- Anorganische Chemie: Säure-Base Chemie (Brönsted-Definitionen)
- Anorganische Chemie: Säure-Base-Puffer und Puffersysteme
- Anorganische Chemie: Säurestärke (pKs) und Basenstärke (pKb)
- Anorganische Chemie: Schwefel
- Anorganische Chemie: Schwefelsäure
- Anorganische Chemie: Stickstoff
- Anorganische Chemie: Struktur von Salzen, Ionengitter und Ionenbildung
- Anorganische Chemie: Übungsaugaben zum Massenwirkungsgesetz (MWG)
- Anorganische Chemie: Vergleich von Ionenbindung und Atombindung
- Anorganische Chemie: Wasserstoff
- Anorganische Chemie: Wie berechnet man Neutralistionsaufgaben (Beispielaufgaben)
- Anorganische Chemie: Wie funktioniert der Lithium-Ionen-Akku?
- Anorganische Chemie: Zink
- Anorgansiche Chemie: Redoxreaktion - Beispielaufgaben
- Biochemie: Biokatalysatoren (Enzyme)
- Chemie: Oxidationszahlen und deren Bestimmung (!)
- Farbigkeit und Molekülstruktur
- Glossar: Fachbegriffe der anorganischen und organischen Chemie mit Erklärungen
- Komplexchemie: Anwendungen der Komplexchemie
- Komplexchemie: Aquakomplexe
- Komplexchemie: Aufbau von Komplexen
- Komplexchemie: Chelatkomplexe
- Komplexchemie: Historischer Abriss der Entdeckung der Komplexchemie
- Komplexchemie: In der Natur vorkommende (biologische) Komplexverbindungen
- Komplexchemie: Komplexe Gleichgewichtsreaktionen und die Stabilitätskonstanten
- Komplexchemie: Komplexstabilitätskonstante und Komplexzerfallskonstante
- Komplexchemie: Ligandenaustauschreaktionen
- Komplexchemie: Nomenklatur (Benennung) von Komplexen
- Komplexchemie: Wasserenthärtung
- Ökologische, ökonomische und soziale Nachhaltigkeit in Chemie
- Organische Chemie: Gelatine
- Selektivität und Spezifität von Katalysatoren
- Herstellung von Maßlösungen
- I-Effekte beeinflussen die Säurestarke von Carbonsäuren
- Organische Chemie: Oxidative Fettumwandlung (Ranzigwerden von Fetten)
- Organische Chemie: Alkane - feste Alkane // Wachse und Paraffine
- Organische Chemie: Alkane - flüssige Alkane
- Organische Chemie: Alkane - gasförmige Alkane
- Organische Chemie: Alkanole (Alkohole)
- Organische Chemie: Alkene und Alkine
- Organische Chemie: Alkohol und seine Wirkung auf Menschen
- Organische Chemie: Alkoholate
- Organische Chemie: Alkohole: Ethanolherstellung durch alkoholische Gärung und großtechnische Produktion
- Organische Chemie: Aminosäuren - Peptidbindung, Typen, Aufbau, Reaktionen
- Organische Chemie: Anorganische Ester
- Organische Chemie: Aufgaben und Übungen zur Nomenklatur bei organischen Verbindungen
- Organische Chemie: Benzin und Diesel
- Organische Chemie: Bestimmung von Schmelz- und Siedepunkten
- Organische Chemie: Biogasanlagen
- Organische Chemie: Brennbarkeit von Kohlenwasserstoffen
- Organische Chemie: Carbonsäuren: homologe Reihe, Verwendung
- Organische Chemie: Carbonylverbindungen - Aldehyde
- Organische Chemie: Carbonylverbindungen - Ketone
- Organische Chemie: chemische Nachweise bei organischen Verbindungen
- Organische Chemie: Cis-/ trans-Isomerie und E/Z-Isomerie
- Organische Chemie: Cycloalkane und Cykloalkene
- Organische Chemie: Darstellungsweisen organischer Verbindungen
- Organische Chemie: Der Einfluss der I-Effekte auf die Säurestärke
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
- Organische Chemie: Propan
- Organische Chemie: Radikalische Substitution
- Organische Chemie: Reaktionsmechanismen der organischen Chemie (Übersicht)
- Organische Chemie: Redoxreaktionen und Oxidationszahlen bei organischen Verbindungen
- Organische Chemie: Saccharose
- Organische Chemie: Schmelz- und Siedebereiche von Fetten und Ölen
- Organische Chemie: Schmelz- und Siedepunkte von Alkanen und Alkenen
- Organische Chemie: Schmerzmittel
- Organische Chemie: Spiegelbildisomerie (Stereoisomerie)
- Organische Chemie: Stärke (Amylose und Amylopektin)
- Organische Chemie: Struktur- und Eigenschaftsbeziehungen bei organischen Kohlenwasserstoffen
- Organische Chemie: Tenside
- Organische Chemie: Titration von Glycin
- Organische Chemie: Typen von Carbonsäuren
- Organische Chemie: Verbrennung von Alkanen und CO2-Emission
- Organische Chemie: Vergleich von Siedepunkten bei Alkanen, Alkanolen, Aldehyden und Carbonsäuren
- Organische Chemie: Verseifung
- Organische Chemie: Viskosität
- Organische Chemie: Was ist Organische Chemie?
- Organische Chemie: Zusammensetzung von Waschmitteln
- Organische Chemie: Zusammensetzung von Waschmitteln und deren Funktion
- Organische Chemie: Zwischenmolekulare Kräfte und Anziehungskräfte zwischen Molekülen
- Physikalische Chemie: Die Grundlagen der Thermodynamik