Chemie
- Details
- Zugriffe: 20276
Name: Viona H., 2017-11
Chemische Reaktionen
Bei einer chemischen Reaktion findet eine Stoffumwandlung unter Freisetzung oder Abgabe von Energie (pro Zeiteinheit) statt. Die Energie kommt in unterschiedlichen Formen vor.
Beispiele:
- chemische Energie
- elektrische Energie
- kinetische Energie (Objekte, die sich bewegen)
- thermische Energie (Feuer spendet nicht nur Wärmeenergie, sondern auch Licht)
Die chemische Thermodynamik ist die Lehre von der Energieübertragung und -umwandlung bei chemischen Reaktionen.
System und Umgebung
Bevor man einen Energieumsatz definiert, muss man sich den räumlich abgegrenzten Sektor, welchen man betrachten möchte, bewusst machen.
Dieser beschränkte Abschnitt des Raums wird System genannt (z.B.: Reagenzglas) und den Restbestand nennt man Umgebung.
Es gibt drei Formen des Systems:
- Jeder Stoff- oder Energieaustausch mit der Umgebung ist bei einem isolierten System unterbrochen.
- Bei einem geschlossenen System kann kein Stoff austreten oder hineingelangen. Jedoch findet ein Energieaustausch mit der Umgebung statt.
- Ein offenes System hat eine Verbindung zu seiner Umgebung. Es erfolgt ein Austausch von Energie und Stoffen.
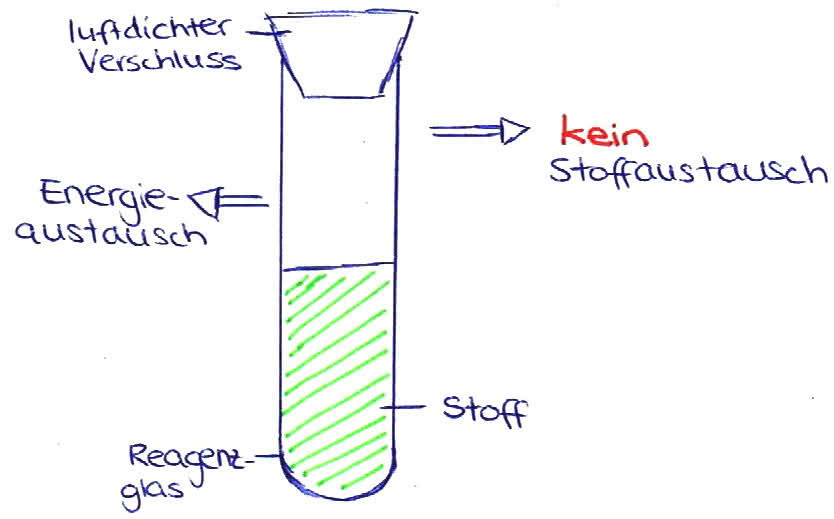
geschlossenes System
(tatsächlich entweicht auch hier Wärme durch die Glaswand - ein komplett geschlossenes System ist nicht möglich!)
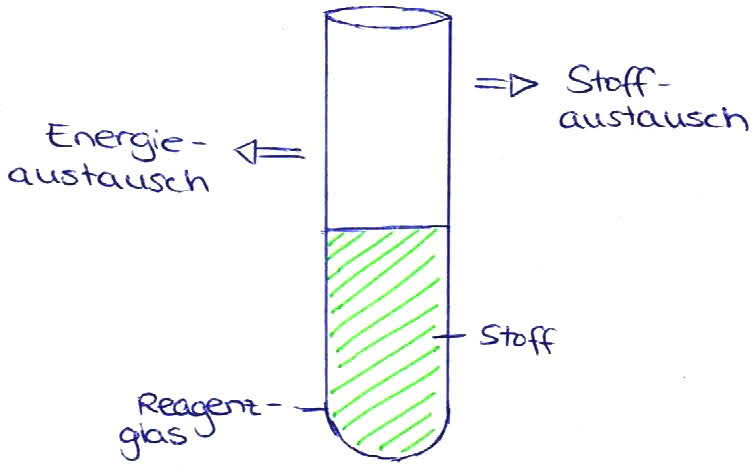
offenes System
(Stoffe und Energie können leicht entweichen!)
Beispiele für offene und geschlossene Systeme:
- Ein Thermogefäß ist annähernd als isoliertes System anzusehen (isoliertes System = idealisierte Vorstellung ; es gibt kein zu "100%" verschlossenes System). Es erfolgt kein Stoffaustausch und nur extrem wenig Wärme verlässt das System. ; Kalorimeter (siehe: Bestimmung einer Reaktionswärme "Kalorimeter")
- Aus einem luftdichten verschlossenen Reagenzglas können keine Stoffe ein- oder austreten, aber Energie kann aufgenommen oder abgegeben werden. ; Solarzelle (BILD 1)
- Stoffe (gasförmig oder flüssig) können aus einem Reagenzglas austreten oder hineingelangen. Ebenfalls kann Energie aufgenommen oder abgegeben werden. ; Mensch: Wärmeaustausch mit der Umgebung ; Lagerfeuer ; Blätter grüner Pflanzen (BILD 2)
Der Energieerhaltungssatz gilt für die Gesamtheit eines Systems mit seiner Umgebung.
Die Gesamtenergie verändert sich nicht. Sie kann umgewandelt werden (z.B: kinetische Energie in thermische Energie) und kann das System verlassen oder hineintransportiert werden. Aber Energie kann nicht erzeugt oder vernichtet werden.
Reaktionswärme
Die bei den meisten chemischen Reaktionen aufgenommen oder abgegebene Wärme wird Reaktionswärme Qr genannt.
Bei endothermen Reaktionen wird Wärme aus der Umbegebung aufgenommen.
Bei exothermen Reaktionen wird Wärme in die Umgebung freigesetzt.
endtherme Reaktionen: Qr > 0
exotherme Reaktionen: Qr < 0
Hierbei gibt es verschiedene Reaktionswärmen, die je nach Art der Reaktion ihren Namen verleiht bekommen.
Beispiele:
- Verbrennungswärme
- Zersetzungswärme
- Lösungswärme
- Neutralisationswärme
- Bildungswärme
Bei einigen Reaktionen sind die Reaktionsprodukte besonders bedeutsam (z.B.: Reaktion des Chlors mit Metallen). Und bei anderen Reaktionen ist die Reaktionswärme sehr wichtig (z.B.: Verbrennung von Holz).
Außerdem kann man durch die Reaktionswärme viele und wichtige Feststellungen über Eigenschaften und Reaktionsverhalten von Stoffen treffen.
Bestimmung einer Reaktionswärme
Kommt es in einem geschlossenen oder offenen System zu einer Erhöhung der Temperatur, dann findet eine endotherme oder exotherme Reaktion statt. Die Wärme wird freigesetzt und ein Ausgleich der entstandenen Temperaturdifferenz zur Umgebung wird vollzogen.
Um die Reaktionswärme Qr zu bestimmen, braucht man einen künstlich abgetrennten Bereich, das Kalorimeter.
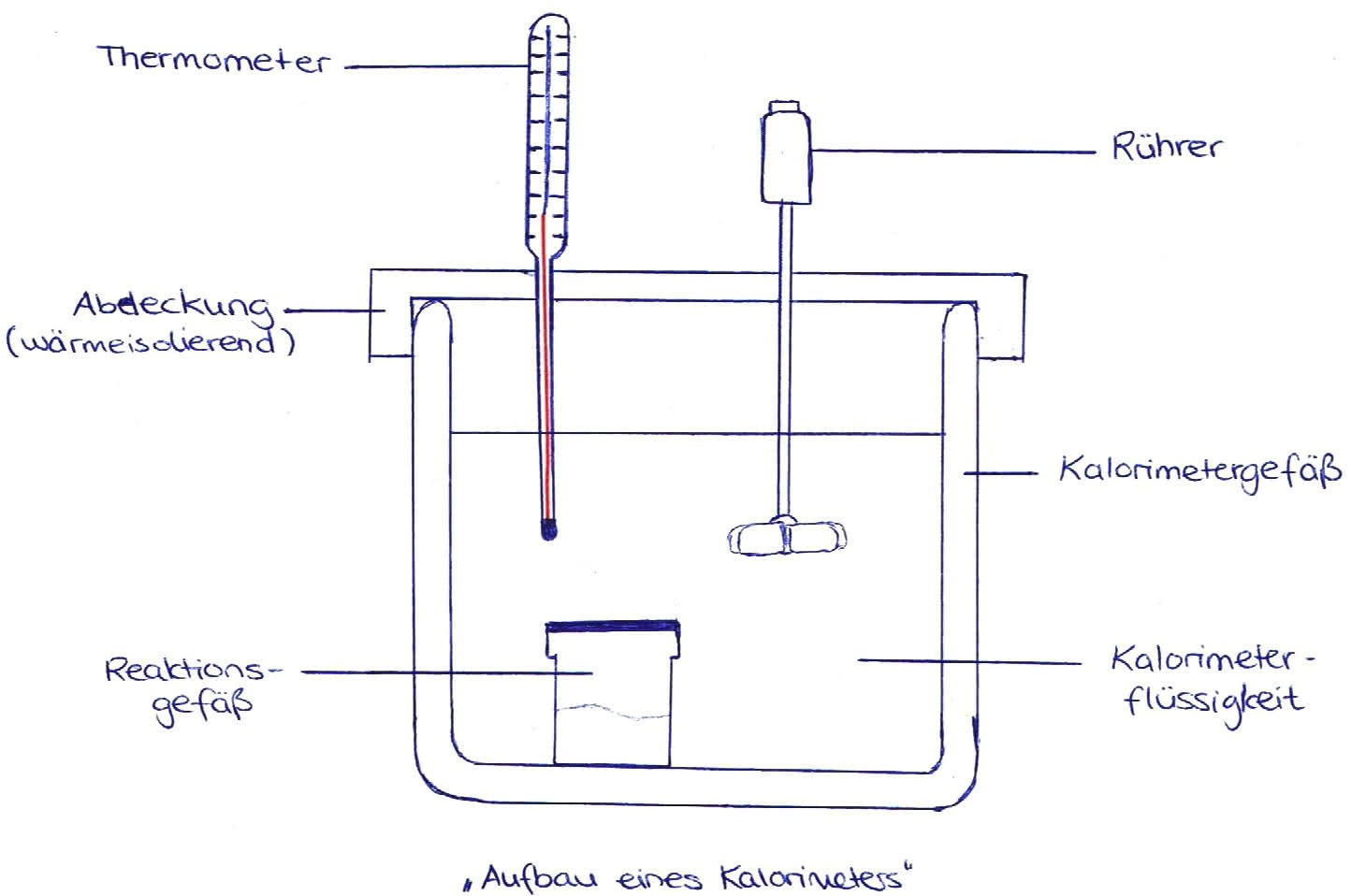
Ein Kalorimeter, wegen des Überdrucks im Inneren auch Bombenkalorimeter genannt
Die gesamte Reaktionswärme Qr wird vom Wasser und dem Kalorimeter angenommen:
Q = –Qr
Zudem ist die Wärme proportional zur Temperaturdifferenz Δθ:
Q = –Qr = C · Δθ ⇔ Qr = –C · Δθ
Der Proportionalitätsfaktor ist die Wärmekapazität C:
C = Ck + Cw
Die Gleichung der Reaktionswärme Qr lautet:
Qr = – (Ck + Cw) · Δθ = – (Ck + cw · mw) · Δθ
Wärmeübergang von System zu System
Besteht eine Temperaturdifferenz zwischen zwei offenen Systemen wird die Energie in Form von thermischer Energie (z.B.: Wärme) übertragen.
Je höher die Temperatur, desto höher die Teilchengeschwindigkeit.
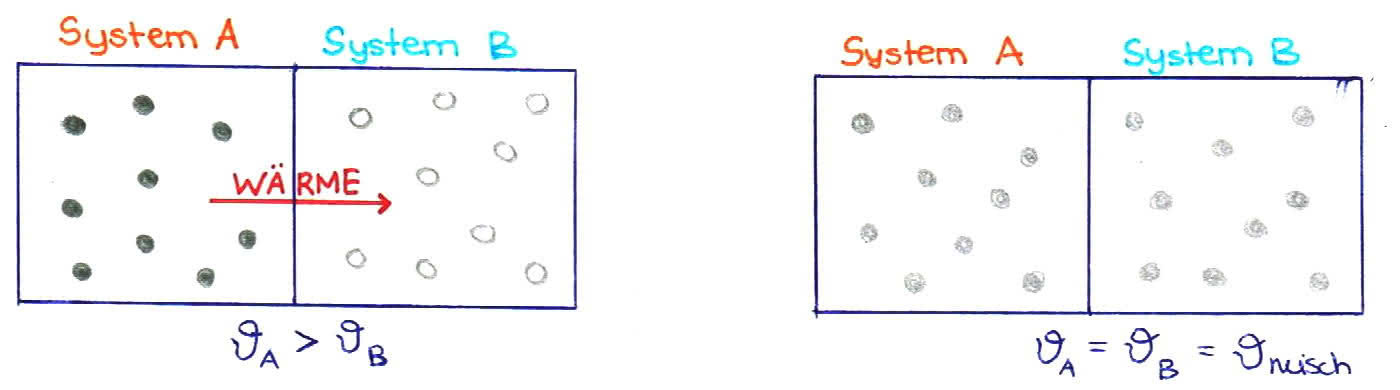
Anfangszustand: kinetische Energie der Teilchen ist in System A größer als in System B
Endzustand: wird erreicht, wenn beide Systeme die gleiche kinetische Energie der Teilchen besitzen
Glossar
Erhaltungsgröße = Wert einer Größe (z.B.: Energie)
Erhaltungssatz = die Tatsache, dass sich die Erhaltungsgröße in bestimmten biologischen, physikalischen oder chemischen Prozessen nicht ändert
Kalorimeter = ein Messgerät zur Bestimmung der Wärmemenge (gesamte Reaktionswärme), die bei z.B.: chemischen Prozessen aufgenommen oder abgegeben wird
Größen
Q: Wärme
Qr: Reaktionswärme
θ: Temperatur
Δθ: Temperaturdifferenz (zwischen Endtemperatur θ2 und Anfangstemperatur θ1 ; Δθ = θ2 – θ1)
C: Wärmekapazität
Ck: Wärmekapazität des Kalorimeters (experimentelle Bestimmung)
Cw: Wärmekapazität einer Wasserportion (Berechnung mit Masse: Cw = cw · mw)
cw: spezifische Wärmekapazität des Wassers ; cw = 4,1868 J/(g·K)
mw: Masse einer Wasserportion
- Anorganische Chemie: Das Deacon-Verfahren
- Anorganische Chemie: Das Löslichkeitsprodukt
- Anorganische Chemie: Das Massenwirkungsgesetz
- Anorganische Chemie: Das Orbitalmodell - ein modernes Atommodell
- Anorganische Chemie: Der Einfluss der Konzentration auf die Reaktionsgeschwindigkeit & deren Bestimmung
- Anorganische Chemie: Der Protolysegrad von Säuren und Basen
- Anorganische Chemie: Der Springbrunnenversuch (mit HCl und NH3)
- Anorganische Chemie: Die Normalwasserstoffhalbzelle und die Spannungsreihe
- Anorganische Chemie: Edelgase - Argon
- Anorganische Chemie: Edelgase - Helium
- Anorganische Chemie: Edelgase - Neon
- Anorganische Chemie: Edelgase - Radon
- Anorganische Chemie: Edelgase - Xenon
- Anorganische Chemie: Einflussfaktoren auf die Reaktionsgeschwindigkeit
- Anorganische Chemie: Elektrolyse
- Anorganische Chemie: Elektrolyte in der Elektrochemie
- Anorganische Chemie: Energie, Enthalpie & Entropie chemischer Reaktionen
- Anorganische Chemie: Entropie
- Anorganische Chemie: Erdalkalimetalle - Barium
- Anorganische Chemie: Erdalkalimetalle - Beryllium
- Anorganische Chemie: Erdalkalimetalle - Calcium
- Anorganische Chemie: Erdalkalimetalle - Magnesium
- Anorganische Chemie: Erdalkalimetalle - Strontium
- Anorganische Chemie: Erstellen von Valenzstrichformeln / Lewis-Formeln
- Anorganische Chemie: Freie Enthalpie, Gibbs-Helmholtz und Reaktions- und Bildungsenthalpie
- Anorganische Chemie: Galvanisches Element & Daniell-Element
- Anorganische Chemie: Gasgleichgewichte, Kp und das MWG
- Anorganische Chemie: Halogene - Astat
- Anorganische Chemie: Halogene - Brom
- Anorganische Chemie: Halogene - Chlor
- Anorganische Chemie: Halogene - Iod
- Anorganische Chemie: Heterogene Katalyse
- Anorganische Chemie: Historische Entwicklung des Säure-Base-Begriffs (Arrhenius & Brönstedt)
- Anorganische Chemie: Innere Energie, Enthalpie und Verbrenungsenthalpien
- Anorganische Chemie: Ionen und Ionenbildung
- Anorganische Chemie: Ionisierungsenergie, Elektroaffinität und Elektronegativität
- Anorganische Chemie: Ist Natronlauge eine Base? (Protolyse)
- Anorganische Chemie: Katalysator und Katalyse
- Anorganische Chemie: Kollisionsmodell & Stoßtheorie
- Anorganische Chemie: Konzentrationselemente und die Nernstgleichung (noch frei)
- Anorganische Chemie: Krypton
- Anorganische Chemie: Kupfer und Kupfergewinnung
- Anorganische Chemie: Legierungen
- Anorganische Chemie: Löslichkeit und Löslichkeitsgleichgewichte
- Anorganische Chemie: Metalle - Alkalimetalle
- Anorganische Chemie: Metalle - Allgemeine Übersicht, Eigenschaften, Verwendung
- Anorganische Chemie: Metalle - Aluminium und Aluminiumverbindungen
- Anorganische Chemie: Metalle - Eisen und Eisenverbindungen
- Anorganische Chemie: Metalle - Erdalkalimetalle
- Anorganische Chemie: Metalle - Gold
- Anorganische Chemie: Metalle - Korrosion und Korrosionsschutz
- Anorganische Chemie: Metalle - Kupfer und Kupferverbindungen
- Anorganische Chemie: Metalle - Uran
- Anorganische Chemie: Metalle und die Metallbindung
- Anorganische Chemie: Oxidationsstufen des Mangans
- Anorganische Chemie: Periodensystem (!)
- Anorganische Chemie: pH-Abhängigkeit von Redoxpotentialen (über die Nernst-Gleichung)
- Anorganische Chemie: pH-Elektrode & elektrochemische pH-Wert-Bestimmung
- Anorganische Chemie: pH-Wert (und pOH-Wert)
- Anorganische Chemie: Phosphor
- Anorganische Chemie: Photovoltaik und Brennstoffzelle
- Anorganische Chemie: Protolyse von Phosphorsäure
- Anorganische Chemie: Protolysereaktionen bei Salzen (Säure-Base Reaktionen)
- Anorganische Chemie: Reaktion von Säuren und Basen mit Wasser
- Anorganische Chemie: Reaktionsgeschwindigkeit und Messung der Reaktionsgeschwindigkeit
- Anorganische Chemie: Reaktionsgeschwindigkeit, Momentangeschwindigkeit und Messung (sowie HWZ)
- Anorganische Chemie: Reaktionsgeschwindigkeitsmessung von Thiosulfationen mit Säure
- Anorganische Chemie: Redoxreaktionen aufstellen
- Anorganische Chemie: Redoxreaktionen im Alltag
- Anorganische Chemie: Salpetersäure HNO₃ - Herstellung, Verwendung, Eigenschaften
- Anorganische Chemie: Salpetrige Säure
- Anorganische Chemie: Salze
- Anorganische Chemie: Salzherstellung durch Neutralisation
- Anorganische Chemie: Sauerstoff
- Anorganische Chemie: Sauerstoffsäuren des Chlors
- Anorganische Chemie: Sauerstoffsäuren des Phosphors
- Anorganische Chemie: Säure-Base Chemie (Brönsted-Definitionen)
- Anorganische Chemie: Säure-Base-Puffer und Puffersysteme
- Anorganische Chemie: Säurestärke (pKs) und Basenstärke (pKb)
- Anorganische Chemie: Schwefel
- Anorganische Chemie: Schwefelsäure
- Anorganische Chemie: Stickstoff
- Anorganische Chemie: Struktur von Salzen, Ionengitter und Ionenbildung
- Anorganische Chemie: Übungsaugaben zum Massenwirkungsgesetz (MWG)
- Anorganische Chemie: Vergleich von Ionenbindung und Atombindung
- Anorganische Chemie: Wasserstoff
- Anorganische Chemie: Wie berechnet man Neutralistionsaufgaben (Beispielaufgaben)
- Anorganische Chemie: Wie funktioniert der Lithium-Ionen-Akku?
- Anorganische Chemie: Zink
- Anorgansiche Chemie: Redoxreaktion - Beispielaufgaben
- Biochemie: Biokatalysatoren (Enzyme)
- Chemie: Oxidationszahlen und deren Bestimmung (!)
- Farbigkeit und Molekülstruktur
- Glossar: Fachbegriffe der anorganischen und organischen Chemie mit Erklärungen
- Komplexchemie: Anwendungen der Komplexchemie
- Komplexchemie: Aquakomplexe
- Komplexchemie: Aufbau von Komplexen
- Komplexchemie: Chelatkomplexe
- Komplexchemie: Historischer Abriss der Entdeckung der Komplexchemie
- Komplexchemie: In der Natur vorkommende (biologische) Komplexverbindungen
- Komplexchemie: Komplexe Gleichgewichtsreaktionen und die Stabilitätskonstanten
- Komplexchemie: Komplexstabilitätskonstante und Komplexzerfallskonstante
- Komplexchemie: Ligandenaustauschreaktionen
- Komplexchemie: Nomenklatur (Benennung) von Komplexen
- Komplexchemie: Wasserenthärtung
- Ökologische, ökonomische und soziale Nachhaltigkeit in Chemie
- Organische Chemie: Gelatine
- Selektivität und Spezifität von Katalysatoren
- Herstellung von Maßlösungen
- I-Effekte beeinflussen die Säurestarke von Carbonsäuren
- Organische Chemie: Oxidative Fettumwandlung (Ranzigwerden von Fetten)
- Organische Chemie: Alkane - feste Alkane // Wachse und Paraffine
- Organische Chemie: Alkane - flüssige Alkane
- Organische Chemie: Alkane - gasförmige Alkane
- Organische Chemie: Alkanole (Alkohole)
- Organische Chemie: Alkene und Alkine
- Organische Chemie: Alkohol und seine Wirkung auf Menschen
- Organische Chemie: Alkoholate
- Organische Chemie: Alkohole: Ethanolherstellung durch alkoholische Gärung und großtechnische Produktion
- Organische Chemie: Aminosäuren - Peptidbindung, Typen, Aufbau, Reaktionen
- Organische Chemie: Anorganische Ester
- Organische Chemie: Aufgaben und Übungen zur Nomenklatur bei organischen Verbindungen
- Organische Chemie: Benzin und Diesel
- Organische Chemie: Bestimmung von Schmelz- und Siedepunkten
- Organische Chemie: Biogasanlagen
- Organische Chemie: Brennbarkeit von Kohlenwasserstoffen
- Organische Chemie: Carbonsäuren: homologe Reihe, Verwendung
- Organische Chemie: Carbonylverbindungen - Aldehyde
- Organische Chemie: Carbonylverbindungen - Ketone
- Organische Chemie: chemische Nachweise bei organischen Verbindungen
- Organische Chemie: Cis-/ trans-Isomerie und E/Z-Isomerie
- Organische Chemie: Cycloalkane und Cykloalkene
- Organische Chemie: Darstellungsweisen organischer Verbindungen
- Organische Chemie: Der Einfluss der I-Effekte auf die Säurestärke
- Organische Chemie: Die Aminosäure Glycin
- Organische Chemie: Die Chemie der "Shisha"
- Organische Chemie: Die Harnstoffsynthese von Friedrich Wöhler
- Organische Chemie: Eigenschaften von Aminosäuren
- Organische Chemie: Einfluss von Molekülmasse und Van der Waals-Kräften auf die Schmelz- und Siedepunkte
- Organische Chemie: Elektrophile und nukleophile Addition
- Organische Chemie: Eliminierung
- Organische Chemie: Energetische Betrachtung organischer Reaktionen
- Organische Chemie: Erdöl und Erdgas
- Organische Chemie: Erdöldestillation zur Gewinnung von Kohlenwasserstoffen
- Organische Chemie: Ester und die Veresterung
- Organische Chemie: Esterspaltung durch Hydrolyse
- Organische Chemie: Ethan
- Organische Chemie: Ethanol
- Organische Chemie: Ethen, Propen und Buten
- Organische Chemie: Ethin
- Organische Chemie: Ethin, Propin, Butin
- Organische Chemie: Färbeverfahren
- Organische Chemie: Fehlingprobe & Tollens-Probe
- Organische Chemie: Fehlingprobe und reduzierende Eigenschaften bei Kohlenhydraten
- Organische Chemie: Fette
- Organische Chemie: Fetthärtung und Margarineherstellung
- Organische Chemie: Fettsäuren
- Organische Chemie: Fischer-Projektion und die Umwandlung in die Haworth-Projektion
- Organische Chemie: Fluor-Chlor-Kohlenwasserstoffe (FCKW)
- Organische Chemie: Fruchtsäuren
- Organische Chemie: Fructose
- Organische Chemie: Galactose (!)
- Organische Chemie: Glucose (Traubenzucker)
- Organische Chemie: Glycogen (tierische Stärke)
- Organische Chemie: Glycosidische Bindung
- Organische Chemie: Gummi und Kautschuk
- Organische Chemie: Halogenalkane (!)
- Organische Chemie: Homologe Reihe der Alkane (!)
- Organische Chemie: I-Effekte
- Organische Chemie: Insulin
- Organische Chemie: Isobuten
- Organische Chemie: Isomaltose & Maltose als typische Disaccharide
- Organische Chemie: Isomerieformen
- Organische Chemie: Kerosin und Schweröl als Erdölbestandteile
- Organische Chemie: Keto-En(di)ol-Tautomerie bei Monosacchariden
- Organische Chemie: Kohle und Graphit
- Organische Chemie: Kohlenhydrate - Disaccharide
- Organische Chemie: Kunststoffe I - Allgemeines und radikalische Polymerisation
- Organische Chemie: Kunststoffe im Vergleich: Thermoplaste
- Organische Chemie: Lactose
- organische Chemie: Löslichkeit von organischen Verbindungen (polare und apolare Lösungsmittel)
- Organische Chemie: Mechanismus Veresterung
- Organische Chemie: mehrwertige Alkohole (Alkanole)
- Organische Chemie: Methan
- Organische Chemie: Nachweis von Proteinen (Ninhydrin-Reaktion)
- Organische Chemie: Nachweise für ungesättige Fettsäuren
- Organische Chemie: Nitril als wichtiger Kunststoff
- Organische Chemie: Nomenklatur und Benennung von organischen Kohlenwasserstoffen
- Organische Chemie: Nukleophile Addition
- Organische Chemie: Nukleophile Substitution
- Organische Chemie: Optische Aktivität
- Organische Chemie: Oxidation und Reduktion von Aldehyden
- Organische Chemie: Oxidation von Alkoholen
- Organische Chemie: Oxidation von Glucose mit Methylenblau (blaues Wunder)
- Organische Chemie: Pektine
- Organische Chemie: Petrochemie
- Organische Chemie: Plexiglas als Kunststoff
- Organische Chemie: Polare und apolare Lösungsmittel und Lösungmitteleigenschaften (!)
- Organische Chemie: Polykondensation von Nylon
- Organische Chemie: Polysaccharide
